Introducción
Las vitaminas liposolubles son esenciales para los terneros jóvenes y deben incluirse tanto en los sustitutos de la leche como en los iniciadores para terneros. Las principales vitaminas liposolubles (A, D y E) son fundamentales para la salud y el crecimiento de los terneros y deben incluirse en los sustitutos de la leche, los iniciadores y los de crecimiento.
Realicé una revisión de la literatura científica sobre las vitaminas A, D y E y revisé las recomendaciones del comité NASEM de 2021 en los “Requisitos de nutrientes para el ganado lechero” (NASEM, 2021). Para evaluar las recomendaciones de NASEM, utilicé varios modelos de crecimiento de terneros y determiné los requisitos basados en la ingesta de alimento líquido y seco a distintas edades, utilizando programas de alimentación típicos. Evalué los requisitos mínimos para cada vitamina en función de la ingesta tanto del sustituto de leche como del iniciador para terneros para cumplir o superar siempre la recomendación de NASSEM. Para obtener más información sobre este enfoque, consulte el Apéndice B en Calf Note #243. Aquí hay un resumen de la literatura y mis recomendaciones (“Ajustadas”) cuando diferían de las de NASEM.
Vitamina E. El Comité NASEM recomendó una concentración añadida de vitamina E de 2 UI/kg de peso corporal, o aproximadamente 125 UI/d (Tabla 1). También afirmaron que esta tasa de suplementación puede ser inadecuada para terneros en rápido crecimiento. Se ha demostrado que la tasa de aumento de peso corporal afecta los requerimientos de vitamina E (NASEM, 2021). Por lo tanto, cuando se implementan programas de alto crecimiento (es decir, programas que permiten >700 g de GMD), se debe incluir un equivalente adicional de vitamina E.
Los requerimientos recomendados de vitamina E en las dietas para terneros han aumentado a medida que los investigadores informaron sobre el importante papel de la vitamina en la respuesta inmune de los terneros (por ejemplo, Reddy et al., 1987a,b). La vitamina E se ha estudiado con mayor detalle que otras vitaminas desde la publicación del Dairy NRC de 2001. Gran parte del trabajo ha documentado el papel del α-tocoferol en la promoción de la respuesta inmune, principalmente proporcionando capacidad antioxidante al animal y reduciendo los efectos del estrés oxidativo sobre la competencia inmune (Abuelo et al., 2019). Se han informado efectos de los suplementos de vitamina E sobre los índices de respuesta inmune (número de linfocitos, activación de linfocitos, título de anticuerpos en respuesta a la vacunación) en terneros Holstein y terneros Wagyu japoneses (Otomaru et al., 2013; 2015). La vitamina E puede desempeñar un papel en la maduración del sistema inmunológico, como lo indica la producción de óxido nítrico por los leucocitos mononucleares de la sangre (Rajaraman et al., 1998). La producción de óxido nítrico en los leucocitos juveniles es mayor que la de las células maduras; La vitamina E puede desempeñar un papel en la maduración de estas células para mejorar el posible daño celular causado por el exceso de producción de NO. Por el contrario, Schmidt et al. (1998) no informaron ningún efecto de la suplementación con vitamina E (188 frente a 354 UI/d) sobre la hematología de terneros vacunados con toxina Shiga a las cinco y ocho semanas de edad. Además, Waldner et al. (2017) informaron que los terneros con vitamina E sérica inferior a la adecuada para su edad (2 a 7 días de edad, <0,8 μg/mL; >7 días de edad, <0,5 μg/mL) tenían 3,2 veces más probabilidades de ser tratados por enteritis. que los terneros con concentraciones más altas.
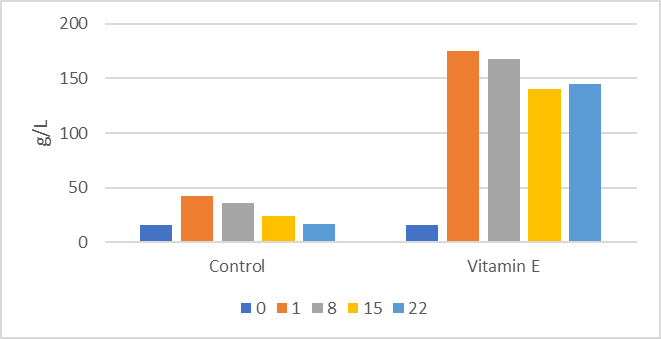
El nivel de vitamina E de los terneros recién nacidos depende en gran medida de la dieta seca de la vaca y del consumo de calostro, que es la ruta principal para el suministro de vitaminas liposolubles en los terneros recién nacidos (Quigley y Bernard, 1995). La suplementación de calostro aumentó el nivel de vitamina E de los terneros recién nacidos (Quigley y Bernard, 1995). Está claro que la variabilidad en el contenido de grasa en general y el contenido de vitaminas liposolubles en el calostro pueden afectar la vitamina E y el estado antioxidante de los recién nacidos. Mohri et al. (2005) informaron que la inyección de vitamina E (300 U de acetato de α-tocoferol/45 kg de peso corporal) y selenio (6 mg/45 kg de peso corporal) alteró la hematología de terneros jóvenes, mejorando en general el número de linfocitos y los índices de capacidad antioxidante. La vacunación de terneros Jersey recién nacidos con 2000 UI de vitamina E una vez por semana durante las dos primeras semanas de vida mejoró enormemente las concentraciones séricas de IgG (Figura 1; Pekmezci y Cakiroglu, 2009). Las concentraciones séricas de IgG superiores a 100 g/l en las primeras etapas de la vida sugieren un aumento espectacular en el inicio de la inmunidad activa y deben considerarse suprafisiológicas.
Reddy et al. (1987b) recomendaron 125 UI/d como el nivel óptimo de suplementación para terneros Holstein jóvenes. Sin embargo, las tasas de alimentación líquida en este estudio fueron bajas (es decir, 8% del peso corporal; Reddy et al., 1987a) y se ha demostrado que el requerimiento de vitamina E aumenta con el crecimiento (Nonnecke et al., 2010). Por lo tanto, es posible que sea necesario variar la suplementación con vitamina E o equivalentes de vitamina E según la tasa de alimentación CMR y la tasa de crecimiento proyectada.
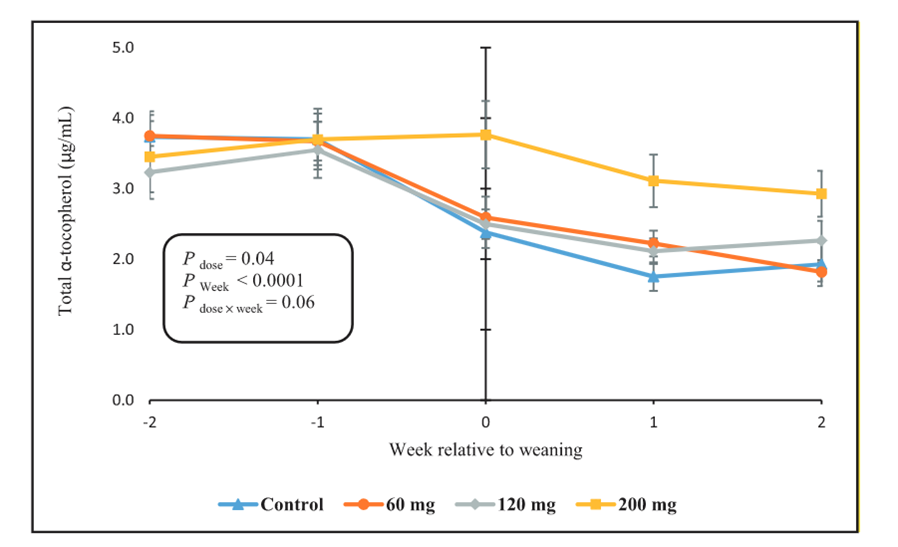
El destete es una transición importante en la vida de los terneros jóvenes y el estado antioxidante reducido de los terneros destetados (Majlesi et al., 2021) puede tener efectos nocivos sobre la resistencia a las enfermedades post-destete. Recientemente, Lashkari et al. (2022) informaron que el RRR-α-tocoferol plasmático era de 0,8 µg/ml al destete (61 días de edad). Generalmente, las concentraciones plasmáticas de vitamina E inferiores a 0,5 a 1,0 µg/ml se consideran inadecuadas en la mayoría de las especies (McDowell et al., 1996) y la vitamina E plasmática de 0,6 a 1,6 µg/ml puede provocar distrofia muscular en los terneros (Adams, 1982).). La disminución de la vitamina E plasmática al destete puede estar relacionada con la transición de una dieta rica en grasas (de leche o sustitutos de la leche) a una que normalmente contiene <5% de grasa en base a MS. Además, la naturaleza de la grasa (potencialmente insaturada) puede interferir con la absorción de α-tocoferol al proporcionar un sustrato inadecuado para la micelarización durante la digestión y el transporte intestinal. Se ha informado de malabsorción de α-tocoferol después del destete (Reddy et al., 1987a). La alimentación con 60 o 120 mg/kg de RRR-α-tocoferol fue insuficiente para mantener las concentraciones plasmáticas de vitamina E, mientras que 200 mg/kg mantuvieron los niveles plasmáticos durante 2 semanas después del destete (Lashkari et al., 2022; Figura 2). Estos autores recomendaron que las concentraciones de α-tocoferol en las dietas suministradas a los terneros alrededor del destete deberían ser de 200 mg/kg de MS. Estos autores también compararon fuentes de vitamina E: 200 mg/d de RRR-α-tocoferol (ALC), 200 mg/d de RRR-α-acetato de tocoferilo (ACT) o 200 mg/d de all-rac-α- acetato de tocoferilo (SYN). Las concentraciones de α-tocoferol en plasma al destete fueron 2,7, 2,1, 1,1 y 0,8 µg/ml para ALC, ACT, SYN y Control, respectivamente (Lashkari et al., 2022). Los autores concluyeron que 200 mg/kg de ALC era la inclusión más eficaz para mantener los niveles plasmáticos de vitamina E alrededor del destete.
Vitamina A. La nueva recomendación de NASEM para la ingesta de vitamina A es 110 UI por kg de peso corporal (Tabla 1) o 11,000 UI/kg en sustituto de leche y 3,700 UI/kg en iniciadores y en crecimiento para terneros (Tabla 2).
Kume y Toharmat (2001) informó resultados con 46 terneros Holstein al nacer y a los 6 días de edad. Las concentraciones tanto de β-caroteno como de vitamina A en plasma aumentan desde el nacimiento hasta los 6 días. El β-caroteno plasmático y la vitamina A plasmática se correlacionaron positivamente con la DM fecal, pero no se observaron correlaciones entre las vitaminas plasmáticas y los componentes de la eritropoyesis. Estos resultados sugieren que el nivel de β-caroteno de los terneros a los 6 días de edad depende de las concentraciones de β-caroteno en el calostro y afecta la aparición de diarrea, y el nivel de vitamina A depende de la transferencia de vitamina A. calostral y de vitamina A placentaria durante la gestación. Eicher et al. (1994) informaron que la combinación de vitaminas A y E puede mejorar la función de los leucocitos desde terneros jóvenes hasta las 6 semanas de edad. En términos de fabricación, la emulsificación de las vitaminas liposolubles en general, y de la vitamina A en particular, mejoran la absorción (Jacobson et al., 1954). Waldner et al. (2017) informaron que los terneros con niveles séricos de vitamina A inferiores a 0,14 μg/ml tenían 2,8 veces más probabilidades de morir, lo que indica el papel que desempeña la vitamina A en la respuesta inmune general.
Vitamina D. La nueva recomendación de NASEM para la ingesta de vitamina D es 32 UI por kg de peso corporal (Tabla 1) o 3200 UI/kg en sustituto de leche y 1100 UI/kg en iniciadores y en crecimiento para terneros (Tabla 2 ).
El nivel de vitamina D de los animales está indicado de manera confiable por la concentración del metabolito 25-hidroxivitamina D (25(OH)D) en suero o plasma, con una concentración de 30 ng/mL propuesta como un umbral inferior de suficiencia. Los terneros suelen nacer con insuficiencia de vitamina D (< 8 ng/ml de 25(OH)D) y pueden permanecer en este estado hasta por 3 meses (Flores-Villalva et al. 1021). Como lo resumen Nelson et al. (2016), las concentraciones séricas de 25(OH)D son de aproximadamente 15 ng/ml al nacer y permanecen ≤15 ng/ml durante 1 mes de edad si se alimentan con leche de desecho pasteurizada con poca o ninguna exposición al sol en verano. Por el contrario, la 25(OH)D sérica de terneros alimentados con un sustituto de leche que contenía 6.600 y 11.000 UI de vitamina D3/kg de materia seca fue de 59 ± 8 y 98 ± 33 ng/ml, respectivamente, al mes de edad (Nelson et al. ., 2019). Los terneros suplementados de manera similar indicaron que la 25(OH)D sérica alcanzada aproximadamente al mes de edad aumentaría de 6 a 7 ng/mL por cada 1000 UI de vitamina D3/kg de materia seca de sustituto de leche. Blakely y cols. (2019) sugirieron que la suplementación de la leche de desecho pasteurizada con vitaminas A, D y E (0,25 o 0,50 ml/día de un producto que contenga 50.000 UI de vitamina A como palmitato de retínalo, 50.000 UI de vitamina D3 y 500 UI de vitamina E como RRR-α-tocoferol por mililitro de producto) más 0,5 ml del mismo suplemento inyectado al nacer dieron como resultado tasas de crecimiento más bajas hasta los 28 días de edad que los terneros no suplementados, probablemente debido al exceso de suplementación vitamínica. Por tanto, parece haber un límite superior para la suplementación con vitaminas liposolubles. Finalmente, investigadores en China sugirieron que la alimentación con 25(OH)D en CMR consumía más alimento seco y crecía más rápido que los controles no suplementados (pero de manera similar a los terneros alimentados con vitamina D3) y reducía los índices de estrés asociados con el destete a los 60 días en comparación con los no suplementados. controles (Xu et al., 2021; Wang et al., 2022).
Resumen y recomendaciones. Los requisitos de vitaminas liposolubles (UI/d) se encuentran en la Tabla 1. Estas ecuaciones pueden incorporarse a modelos predictivos. Recomendamos requisitos ajustados con preferencia a los publicados por NASEM. Recomendamos aumentar las concentraciones de vitamina A y D en un 10 % para tener en cuenta la oxidación normal en los alimentos durante la fabricación y el almacenamiento de los alimentos. La Tabla 5 contiene las inclusiones recomendadas de vitaminas liposolubles en el sustituto de leche y el iniciador para proporcionar una ingesta adecuada para terneros de 35 a 125 kg.
| NASEM | Ajustada | ||
| Vitamina | IU/día | IU/día (min) | |
| Vit A | 110 * BW | 110 * BW * 1.1 | |
| Vit D | 32 * BW | 32 * BW * 1.1 | |
| Vit E | 2 * BW | 2 * BW | |
| Vit E equivalente* | 4 * BW |
*Para terneros alimentados con suficiente energía y proteínas para alcanzar ≥700 g de GMD, se recomienda un equivalente adicional de vitamina E. El equivalente de vitamina E puede ser proporcionado por vitamina E o precursores de vitamina E. BW = peso corporal en kilogramos.
| NASEM, IU/kg DM | Ajustada, IU/kg DM | ||||||
| Vitamina | CMR | Iniciador | Productor | CMR | Iniciador | Productor | |
| Vit A | 11,000 | 3,700 | 3,700 | 11,000 | 4,500 | 4,500 | |
| Vit D | 3,200 | 1,100 | 1,100 | 3,500 | 1,300 | 1,300 | |
| Vit E | 200 | 67 | 67 | 200 | 80 | 80 | |
| Vit E equiv.* | 300 | 160 | 160 | ||||
* Para terneros alimentados con suficiente energía y proteínas para alcanzar ≥700 g de GMD, se recomienda un equivalente adicional de vitamina E. El equivalente de vitamina E puede ser proporcionado por vitamina E o precursores de vitamina E.
Referencias
Abuelo, A., J. Hernández, J. L. Benedito, and C. Castillo. 2019. Redox biology in transition periods of dairy cattle: Role in the health of periparturient and neonatal animals. Antioxidants (Basel). 13:20. https://doi.org/10.3390/antiox8010020.
Adams, C. 1982. Feedlot cattle need supplemental vitamin E. Feedstuffs. 54:24.
Blakely, L. P., M. B. Poindexter, R. L. Stuart, and C. D. Nelson. 2019. Supplementing pasteurized waste-milk with vitamins A, D, and E improves vitamin status of dairy calves. The Bovine Practitioner. 53:134–141. https://doi.org/10.21423/bovine-vol53no2p134-141.
Flores-Villalva, S., M. B. O’Brien, S. Reid, S. Lacey, S. V. Gordon, C. Nelson, and K. G. Meade. 2021. Low serum vitamin D concentrations in spring-born dairy calves are associated with elevated peripheral leukocytes. Sci. Rep. 11:18969. https://doi.org/10.1038/s41598-021-98343-8.
Jacobson, N. L., R. S. Allen, J. T. Blake, and P. G. Homeyer. 1954. The effect of method of administration on the absorption and storage of vitamin A by dairy calves: Two figures. J. Nutr. 54:143–153. https://doi.org/10.1093/jn/54.1.143.
Kume, S., and T. Toharmat. 2001. Effect of colostral β-carotene and vitamin A on vitamin and health status of newborn calves. Livestock Prod. Sci. 68:61-65. https://doi.org/10.1016/S0301-6226(00)00214-1.
Lashkari, S., S. K. Jensen, and M. Vestergaard. 2022. Response to different sources of vitamin E orally injected and to various doses of vitamin E in calf starter on the plasma vitamin E level in calves around weaning. Animal. 16:100492. https://doi.org/10.1016/j.animal.2022.100492.
Majlesi, A., S. P. Yasini, S. Azimpour, and P. Mottaghian. 2021. Evaluation of oxidative and antioxidant status in dairy calves before and after weaning. Bulg. J. Vet. Med. 24:184-190. https://doi.org/10.15547/bjvm.2270.
McDowell, L. R., S. N. Williams, N. Hidiroglou, C. A. Njeru, G. M. Hill, L. Ochoa, and N. S. Wilkinson. 1996. Vitamin E supplementation for the ruminant. Anim. Feed Sci. Technol. 60:273-296. https://doi.org/10.1016/0377-8401(96)00982-0.
Mohri, M. H., A. Seifi, and J. Khodadadi. 2005. Effects of preweaning parenteral supplementation of vitamin E and selenium on hematology, serum proteins, and weight gain in dairy calves. Comp. Clin. Pathol. 14: 149–154. https://doi.org/10.1007/s00580-005-0581-3.
National Academies of Sciences, Engineering, and Medicine. 2016. Nutrient Requirements of Beef Cattle: Eighth Revised Edition. Washington, DC: The National Academies Press. https://doi.org/10.17226/19014.
Nelson, C. D., J. D. Lippolis, T. A. Reinhardt, R. E. Sacco, J. L. Powell, M. E. Drewnoski, M. O’Neil, D. C. Beitz, and W. P. Weiss. 2016. Vitamin D status of dairy cattle: Outcomes of current practices in the dairy industry. J. Dairy Sci. 99:10150-10160. https://doi.org/10.3168/jds.2016-11727.
Nonnecke, B. J., M. R. Foote, B. L. Miller, D. C. Beitz, and R. L. Horst. 2010. Short communication: Fat-soluble vitamin and mineral status of milk. replacer-fed dairy calves: Effect of growth rate during the preruminant period. J. Dairy Sci. 93:2684–2690. https://doi.org/10.3168/jds.2009-2892.
Otomaru, K. S. Saito, K. Endo, M. Kohiruimaki, S. Fukuyama, and H. Ohtsuka. 2013. Effect of supplemental vitamin E on antibody titer in Japanese black calves vaccinated against bovine herpesvirus-1. J. Vet. Med. Sci. 75:1671–1673. https://doi.org/10.1292/jvms.13-0215.
Otomaru, K., S. Saito, K. Endo, M. Kohiruimaki, and H. Ohtsuka. 2015. Effect of supplemental vitamin E on the peripheral blood leukocyte population in Japanese Black calves. J. Vet. Med. Sci. 77:985–988. https://doi.org/10.1292/jvms.15-0060.
Pekmezci, D., and D. Cakiroglu. 2009. Investigation of immunomodulatory effects of levamisole and vitamin E on immunity and some blood parameters in newborn Jersey calves. Vet. Res. Commun. 33:711–721. https://doi.org/10.1007/s11259-009-9220-9.
Quigley III, J. D., and J. K. Bernard. 1995. Effects of addition of vitamin E to colostrum on serum α‐tocopherol and immunoglobulin concentrations in neonatal calves. Food and Ag. Immunol. 7:295-298. https://doi.org/10.1080/09540109509354887.
Rajaraman, V., B. J. Nonnecke, S. T. Franklin, D. C. Hammel, and R. L. Horst. 1998. Effects of vitamin A and E on nitric oxide production by blood mononuclear leukocytes from neonatal calves fed milk replacer. J. Dairy Sci. 81:3278–3285. https://doi.org/10.3168/jds.S0022-0302(98)75892-8.
Reddy, P. G., J. L. Morrill, and R. A. Frey. 1987a. Vitamin E requirements of dairy calves. J. Dairy Sci. 70:123-129. https://doi.org/10.3168/jds.S0022-0302(87)79987-1.
Reddy, P. G., J. L. Morrill, H. C. Minocha, and J. S. Stevenson. 1987b. Vitamin E is immunostimulatory in calves. J. Dairy Sci. 70:993-999. https://doi.org/10.3168/jds.S0022-0302(87)80104-2.
Schmidt, N., T. Luhmann, L. Hüther, U. Meyer, S. A. Barth, L. Geue, C. Menge, J. Frahm, and S. Dänicke. 2018. Effect of vitamin E supplementation in milk replacer and Shiga toxoid vaccination on serum α-tocopherol, performance, haematology and blood chemistry in male Holstein calves. Anim. Physiol. Anim. Nutr. 102:1167-1180. https://doi.org/10.1111/jpn.12926.
Waldner, C. L. and F. D. Uehlinger. 2016. Factors associated with serum vitamin A and vitamin E concentrations in beef calves from Alberta and Saskatchewan and the relationship between vitamin concentrations and calf health outcomes. Can. J. Anim. Sci. 97:65-82. https://doi.org/10.1139/cjas-2016-0055.
Wang, L. H., C. R. Zhang, Q. Y. Zhang, H. J. Xu, G. Z. Feng, G. N. Zhang, and Y. G. Zhang. 2022. Effects of feeding different doses of 25-hydroxyvitamin D3 on the growth performance, blood minerals, antioxidant status and immunoglobulin of preweaning calves. Anim. Feed Sci. Tech. 285:115220. https://doi.org/10.1016/j.anifeedsci.2022.115220.
Xu, H. J., L. H. Wang, Q. Y. Zhang, X. Jiang, C. R. Zhang, and Y. G. Zhang. 2021. Effects of 25-hydroxyvitamin D3 on growth performance, fecal scores, vitamin D3 metabolites, antioxidant status, and inflammatory and stress-related parameters in weaning calves. Anim. Feed Sci. Tech. 281:114946. https://doi.org/10.1016/j.anifeedsci.2021.114946.