Introducción
Varios Calf Notes recientes han analizado las causas de la acidosis ruminal subaguda (SARA) en vacas y terneros (#170, #172, y #173). Esta nota tiene por objeto evaluar los efectos de SARA en la salud de vacas y terneros.
¿Cómo afecta SARA a la salud?
En una excelente revisión reciente de los efectos de SARA en la salud de las vacas, Plaizier et al. (2012) documentaron con gran detalle los efectos de los desafíos a base de granos en la salud de las vacas. Cuando las vacas (y, por extensión, los terneros) comen mucho grano en un corto período de tiempo (o cuando se enfrentan a grandes cantidades de grano), normalmente hay una reducción en el pH del rumen, lo que puede resultar en sub -acidosis ruminal aguda, o SARA. La investigación sugiere que muchos, si no la mayoría, de los terneros experimentan SARA en algún momento durante el período de desarrollo del rumen. En la mayoría de las investigaciones, SARA se define como un pH ruminal <5,8. Cuando el pH cae a este nivel, la digestión de la fibra se deprime y la vaca (ternero) puede experimentar varios trastornos metabólicos, como un ciclo intermitente de consumo de alimento, estiércol suelto y rendimiento reducido, entre otros problemas.
Un componente clave de SARA en la salud animal es la producción de lipopolisacárido (LPS) que resulta de la muerte de bacterias gramnegativas. También llamado endotoxina, el LPS es una señal para el cuerpo de que se ha producido una invasión bacteriana, y el cuerpo responde movilizando la respuesta inmunitaria para combatir esta nueva infección. Como resultado, hay varios signos claros causados por LPS: fiebre, producción de citocinas proinflamatorias como TNF-α, anorexia y, en casos graves, shock tóxico y muerte.
Normalmente, el LPS se produce en el rumen como resultado del crecimiento y muerte normal de las células bacterianas del rumen. Sin embargo, las concentraciones son generalmente bajas y los sistemas intestinales desintoxican el LPS que sale del rumen. Por ejemplo, las proteasas abomasales, la lisozima y el ácido clorhídrico contribuyen matando o inhibiendo las bacterias. Un pH abomasal bajo también puede desactivar el LPS (Ribeiro et al., 2010). Bertok (1998) también informó que los ácidos biliares provocan la degradación de LPS en el intestino delgado.
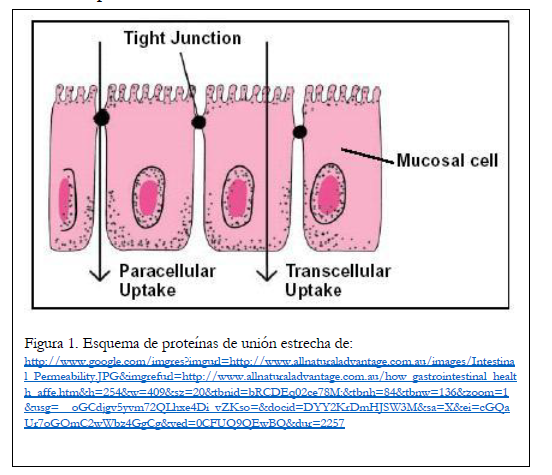
En el caso de un desafío con granos (ingesta de una gran cantidad de granos que contienen grandes cantidades de almidón), varios autores han demostrado que la cantidad de LPS en el fluido ruminal aumenta. Bajo ciertas condiciones, la cantidad de LPS absorbida en la sangre puede aumentar. Una posible razón de este aumento son los efectos del estrés en las proteínas de unión estrecha. Las uniones estrechas son proteínas entre las células epiteliales intestinales (ver Figura 1) y generalmente limitan el movimiento de moléculas entre las células (es decir, la captación paracelular). Por lo tanto, la mayoría de los nutrientes y otras moléculas deben ser absorbidos por las células (captación transcelular). Sin embargo, bajo ciertas condiciones, las proteínas de unión estrecha pierden su capacidad para controlar el movimiento de sustratos desde la luz del intestino y la cantidad de captación paracelular aumenta dramáticamente. Esto a menudo se denomina «intestino permeable» y es causado por una serie de factores, incluidos antígenos, microorganismos, citocinas, frío/calor, cambios en la dieta (p. ej., destete) y otros factores. La mayor permeabilidad permite una mayor captación de LPS y provoca una respuesta inmunitaria correspondiente.
Efectos de la respuesta inmune inducida por SARA
Los datos sugieren que SARA puede hacer que el LPS pase del intestino a la circulación periférica. Cuando el LPS llega a la sangre, se produce una respuesta sistémica, que provoca la producción de proteínas de fase aguda, cambios en la utilización de nutrientes y reducción de la eficiencia de producción. En vacas lactantes, el aumento de las proteínas de fase aguda en plasma se asocia con una reducción de la grasa de la leche, leche corregida con un 3,5 % de grasa y eficiencia de producción (Dong et al., 2011).
¿De dónde viene la LPS?
La sabiduría convencional sugería que el LPS producido por la muerte de las bacterias del rumen era la causa principal del LPS que eventualmente llegaba al torrente sanguíneo y causaba un rendimiento reducido. Sin embargo, Plaizier et al. argumentan que otra fuente de LPS en la sangre proviene de la alta acidez de la digestión en el intestino grueso. Argumentan que el nivel de almidón que llega al intestino delgado y grueso es una consideración importante. Es decir, el almidón que no se fermenta en el rumen (debido a la gran ingesta de almidón junto con la alta tasa de paso) y que no es digerido por el intestino delgado puede llegar al intestino grueso, donde puede ser fermentado por las bacterias del intestino grueso, produciendo grandes cantidades. de ácidos de fermentación. Estos ácidos y la muerte bacteriana que ocurre en el intestino grueso también pueden afectar las uniones estrechas y provocar que el LPS pase a la circulación.
¿Qué efectos en los terneros?
Aunque parece haber evidencia clara de que SARA existe en las vacas y puede tener efectos significativos en la salud, hay pocos datos que sugieran efectos similares en los terneros. Claramente, sin embargo, hay sugerencias de que mecanismos fisiológicos similares podrían desempeñar un papel en los terneros.
Inmediatamente después del destete, es común que la ingesta de alimento iniciador aumente varias veces en cuestión de días, ya que los terneros intentan reemplazar la energía que les proporcionaba la leche. Esto tiene el efecto de duplicar o triplicar la carga de carbohidratos presentada al rumen y las bacterias del rumen para procesar. Dado que las bacterias en el rumen son expertas incluso en etapas tempranas de la vida para fermentar carbohidratos como el almidón y la celulosa en el rumen, esto daría como resultado un rápido aumento en la producción de AGV, el crecimiento microbiano y, potencialmente, en la producción de LPS en el rumen. El efecto combinado de bajo pH, alta acidez y producción de LPS puede resultar en la translocación de bacterias a través de la pared ruminal, el desarrollo de paraqueratosis ruminal y abscesos hepáticos. Ninguno de estos efectos es beneficioso para el ternero.
Cuando las dietas de iniciación para terneros contienen una gran cantidad de almidón, un escenario (propuesto por Plaizier et al.) podría proceder de la siguiente manera: aumento rápido en la ingesta de iniciador con el destete. Dado que el iniciador contiene una gran cantidad de almidón, puede haber un mayor escape de almidón del rumen. La digestión del almidón en el rumen, el intestino delgado y el intestino grueso varía ampliamente entre animales y dietas (Huntington et al., 2006). Si llega más almidón al intestino grueso, podría iniciar la producción de LPS y la subsiguiente respuesta inmunitaria mediante la ruptura de la integridad intestinal y la migración de LPS a la circulación.
En el momento de escribir este artículo, esta hipótesis es una conjetura. No hay datos que sugieran que el LPS ruminal o intestinal aumente en terneros recién destetados, ni que exista una respuesta inmune a tal aumento.
Sin embargo, sabemos que el estrés del destete puede resultar en una supresión inmunológica (p. ej., Hulbert et al., 2011; Kim et al., 2011). Curiosamente, Kim et al. (2011) informaron aumentos en las proteínas de fase aguda y las concentraciones del factor de necrosis tumoral alfa en terneros recién destetados, lo que es consistente con las hipótesis planteadas aquí. Se necesita más investigación para determinar si nuestros métodos de destete y la composición del iniciador alimentado alrededor del destete pueden afectar la inmunidad de los terneros y la predisposición a las enfermedades.