
qнажмите здесь, чтобы открыть PDF-версию
Введение
Недавно у меня состоялся интересный разговор с коллегой и другом об изменчивости результатов анализов в проведенном им исследовании по кормлению молозивом. В этом исследовании мой коллега давал телятам разное количество молозива (2 и 4 литра) с добавлением смеси (0–1 грамм в каждое кормление), которая должна была улучшить кажущуюся эффективность абсорбции IgG у телят. Состав смеси в данном случае не важен, поскольку ее нет в продаже и она оказалась неэффективной.
Мой коллега (назовем его Джон) послал образцы молозива и крови в независимую лабораторию, чтобы определить концентрацию IgG в образцах молозива и сыворотки телят. В лаборатории провели анализ и выслали ему результаты. Когда Джон увидел их, он не поверил своим глазам: вопреки его ожиданиям, показатели сыворотки оказались ниже, а образцы молозива имели более широкий диапазон значений (одни выше, другие ниже). Тогда Джон отослал партию образцов в другую лабораторию для подтверждения результатов. Когда пришли эти результаты, все стало еще хуже. Все показатели в образцах сыворотки из второй лаборатории были ниже, чем из первой, а показатели в образцах молозива — гораздо ближе друг к другу по значениям, но все выше, чем в результатах первой лаборатории! Можете себе представить, как был смущен и расстроен этим разбросом результатов Джон. Он-то ожидал, что все результаты анализа окажутся одинаковыми, но этого не произошло.
В чем же дело? Перед тем как погружаться в специфику этих двух лабораторий и результаты их работы, давайте немного обсудим анализ на иммуноглобулины и сущность тех анализов, которые мы сейчас используем.
Анализ на иммуноглобулины
Существует несколько методов определения содержания IgG в разных материалах. Чаще всего используется метод радиальной иммунодиффузии (РИД). К другим популярным методам относятся турбидиметрический иммуноанализ (ТИА) и твердофазный иммуноферментный анализ (твердофазный ИФА).
Все эти исследования основаны на одном принципе. А именно: можно вырастить антитела к антителам и использовать эти выращенные антитела в диагностических целях. Давайте разберемся, что я имею в виду. Начнем с рис. 1, на котором мы видим здоровое животное, в данном случае мышь. Чаще всего используют коз, крыс, мышей и лошадей. Крысы и мыши недороги, их легко содержать, они могут вырабатывать очень специфические антитела к IgG, а козы и лошади могут дать большие объемы сыворотки при низких затратах. Всем этим животным делают инъекции очищенных препаратов антител от других видов — в нашем случае это антитела коров. Поэтому, если мы вводим мыши коровьи IgG, через некоторое время у нее появится иммунный ответ (т. е. ее организм начнет вырабатывать антитела) на введенные IgG. Тогда в сыворотке крови мыши появятся мышиные антитела к коровьим IgG. Затем мы можем взять эту сыворотку и использовать мышиные антитела к коровьим IgG для анализа.
Когда мы смешаем коровьи IgG из сыворотки наших новорожденных телят с мышиными антителами к коровьим IgG, две группы антител должны прореагировать. И, в зависимости от вида анализа, мы можем использовать это взаимодействие, чтобы определить, сколько коровьих IgG у наших телят.
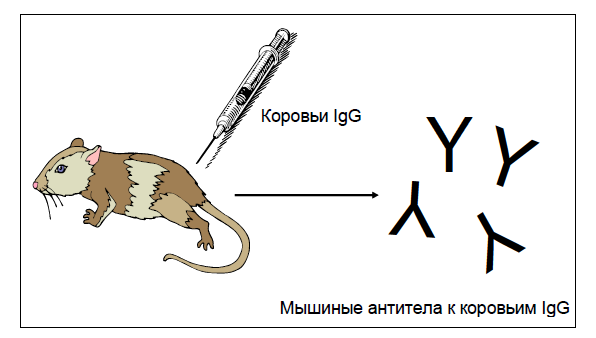
Анализ методом РИД относительно прост: антитела к коровьим IgG смешивают с агаром (желатин, получаемый из морских водорослей) и заливают в чашки Петри. Затем на поверхности агара делают небольшие лунки и заливают в них жидкие образцы.
В течение нескольких последующих часов (РИД для измерения IgG занимает около 24 часов) сыворотка телят диффундирует в агар. При взаимодействии коровьих IgG с мышиными антителами к коровьим IgG формируется преципитат в виде белого непрозрачного кольца вокруг лунки.
Описание методики выполнения анализа методом РИД можно найти на сайте: https://www.lib.mcg.edu/edu/esimmuno/ch4/radial.htm. Далее мы можем оценить размер колец и рассчитать количество коровьих IgG в образце.
Метод ТИА основан на том же принципе (взаимодействие коровьих IgG с антителами к коровьим IgG), но реакция проходит в жидкой среде, а не в агаре. В этом состоит преимущество методики ТИА: он гораздо быстрее, и его можно автоматизировать. Вместо того чтобы измерять диаметр колец (как в методе РИД), можно измерять мутность (непрозрачность) раствора автоматически, что значительно повышает производительность лаборатории.
Методики твердофазного ИФА гибче и сложнее. Существует множество разных подходов к методике твердофазного ИФА. По сравнению с другими методами у него есть много преимуществ, включая скорость, точность и возможность измерять очень малые количества IgG. Этот метод сложнее и требует более развитых технических навыков и оборудования, чем другие методики. Поэтому его, как правило, не столь широко используют для измерения общей концентрации IgG в сыворотке телят в опытах.
Исследование
Итак, вернемся к исследованию. Почему так различались выданные Джону результаты двух лабораторий по концентрациям IgG в молозиве и сыворотке? Как он примирил эти противоречия?
Давайте сначала рассмотрим результаты анализа молозива. Если вы помните, результаты из первой лаборатории были ниже и менее однородны, чем из второй. Молозиво крупного рогатого скота содержит много «частиц», которые могут влиять на миграцию коровьих IgG в агаре при проведении анализа методом РИД. Большое количество жира, казеина и других веществ также может влиять на комплекс IgG / антитела к IgG. К тому же, когда лаборатория получает образец, как его нужно обработать, чтобы обеспечить точность результатов? Нужно ли удалить жир перед началом анализа, чтобы он не взаимодействовал с анализируемым образцом? Или стоит включить его в анализ, чтобы точнее отразить содержание IgG в цельном молозиве? В этом и была суть отличий работы двух лабораторий. В первой лаборатории получили замороженные образцы молозива, разморозили их при комнатной температуре, перемешали их (соединив жировую и белковую фракции молозива) и поместили образец в чашку Петри для анализа методом РИД. Во второй лаборатории получили образец, разморозили его и отобрали пробу жидкости из-под слоя жира. Таким образом, жир фактически был исключен из анализа. Поэтому значения анализируемых показателей IgG были выше, но получены на основе обезжиренного, а не цельного молозива. Чтобы иметь возможность точно сравнить эти значения, Джон должен был знать содержание жира в образцах молозива и рассчитать концентрацию IgG в цельном молозиве.
В 1981 году Fleenor и Stott сообщили о значительных различиях результатов определения концентрации IgG в образцах молозива при разных методах анализа. Они рекомендовали использовать для анализа цельное, а не обезжиренное и не обработанное молозиво. Если образцы необходимо развести (а образцы молозива с концентрацией IgG более 50 г/л обычно необходимо разводить), то для этого нужно использовать образец молока без IgG. Образцы сыворотки также необходимо разводить сывороткой, не содержащей IgG.
Расхождение между результатами лабораторий возникло потому, что нет единого признанного стандартного метода измерения IgG: для этого используются и РИД, и ТИА. Некоторые лаборатории получают более однородные результаты, если удаляют потенциально мешающие вещества, тогда как другие лаборатории предпочитают проводить анализы по самым простым методикам.
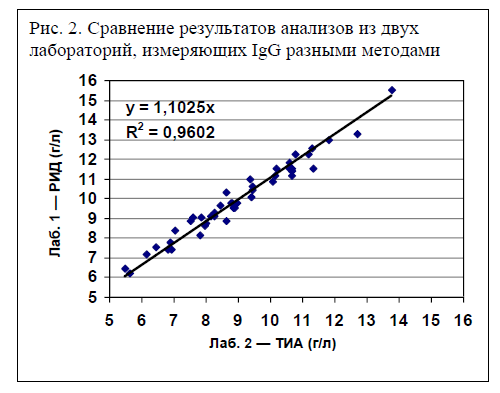
Концентрации IgG в образцах сыворотки также различались в зависимости от лаборатории. Джон захотел сравнить результаты анализов двух лабораторий и построил график (рис. 2). Обратите внимание: результаты в значительной степени совпадают, т. е. если выше значения образцов из одной лаборатории, то выше и соответствующие результаты из другой. Коэффициент детерминации r2 составил 0,96, что означает, что 96% изменчивости значений одной группы можно объяснить изменчивостью значений другой группы. Но это же великолепно! Эти данные показывают, что на самом деле оба вида анализа могут дать точное представление о концентрации IgG в образцах сыворотки.
Уравнение на графике показывает, что Y = 1,1025X. Это означает, что результаты измерения методом РИД на 10,25% превышают результаты анализа методом ТИА. Например, если измерение методом ТИА дало 10 г/л в сыворотке теленка, то для метода РИД эта величина составит 10 × 1,1025 = 11,025 г/л. (ПРИМЕЧАНИЕ. Для полного разоблачения перед вами, строгими статистиками, я увеличил отрезок, отсекаемый на оси координат, по сравнению с оригиналом, что слегка уменьшило значение r2.)
Откуда берется разница в результатах? Важно помнить, что методы РИД и ТИА сильно отличаются. В этих двух лабораториях различны не только методики количественного анализа, но и используемые антитела (в одной работали с антителами коз, в другой — с антителами лошадей). Разумеется, буферная система, используемая в методе ТИА, тоже отличалась от агарового геля в методе РИД.
Так какой же метод анализа «правильный»? Другими словами, какова концентрация IgG в сыворотке: 10 или 11 г/л? Или, скажем иначе, насколько велика эта разница и стоит ли беспокоиться о ней? Что ж, если вас интересует, страдают ли телята НППИ (недостаточностью передачи пассивного иммунитета), т. е. действительно ли концентрация IgG 10 г/л или выше, тогда разница в методах имеет значение. Если мы рассчитаем НППИ в опыте Джона, то по результатам метода РИД у 35% телят будет НППИ, а по результатам метода ТИА — у 47%. С другой стороны, как животновод, могу сказать, что разница между 10 и 11 г IgG/л в сыворотке теленка в возрасте 24 часа не так уж важна.
Существует ли «самый правильный» метод анализа? По-моему, нет. Любой из методов: РИД, ТИА, твердофазный ИФА (и некоторые другие) — может дать очень точные результаты. Хотя метод РИД долгое время считался «золотым стандартом анализа», с ним связаны некоторые сложности, и далеко не всегда он является лучшим (например, при анализе молозива). Другие методы, в частности ТИА, имеют свои преимущества: высокую производительность при низкой себестоимости, что делает выгодным широкий диапазон измерений IgG. Некоторые исследователи сообщают, что измерение концентрации IgG в сыворотке методом ТИА дает столь же точные результаты, что и методом РИД (Davis et al., 2005; Etzel et al., 1997; McCue, 2007).
Несколько рекомендаций: как интерпретировать и публиковать результаты анализа
В целом, достаточно узнать, надежна ли данная лаборатория и выполняет ли она стандартные процедуры методов РИД, ТИА или твердофазного ИФА. Если постоянно сотрудничать с одной и той же лабораторией, можно свести к минимуму изменчивость результатов от разных лабораторий и разных методов анализа. Поговорите с техническим специалистами лаборатории и убедитесь, что у них достаточно опыта проведения анализов и есть соответствующие стандарты и методы внутреннего контроля на месте. Если вам действительно любопытно узнать, насколько точны их анализы концентрации IgG в сыворотке, можете сделать вот что: соберите сыворотку нескольких телят (или коровы), чтобы набралось 50–100 миллилитров. Смешайте все и поместите в отдельные пробирки по 2–3 милиллитра сыворотки. Заморозьте. Время от времени отсылайте им эти пробирки с образцами на анализ. Каждый раз эти результаты (они называются «внутренний контроль») должны быть однородны в разумных пределах (5–10%).
Если они сильно отличаются, пора связаться с лабораторией. Если вас интересуют подробности, вот что вам необходимо знать, если вы действительно хотите понимать результаты анализов IgG от лаборатории, которая их выполняет.
Обработка и подготовка образцов
- Что происходит с образцами после поступления в лабораторию?
- Сколько их хранят?
- Как их размораживают?
- Какие методы предварительной обработки используются?
Отбор антител
- От каких животных получены антитела к коровьим IgG?
- Какова специфичность антител?
- Распознает ли антитело один или несколько эпитопов?
- Специфично ли антитело к IgG1, IgG2 или к ним обоим?
Анализ IgG
- Каким методом был проведен анализ: твердофазным ИФА, ТИА или РИД?
- При каких условиях (буферы, растворители, временные интервалы, температура)?
- Как были интерпретированы и рассчитаны концентрации?
- Какие стандарты были использованы и при каких концентрациях?
- Каковы были коэффициент вариации для серии анализов и среднестатистическая погрешность метода?
Подведем итог
Из разговора с коллегой я понял, что анализы иммунных параметров сложнее, чем многие другие методики анализа. В развитии надежного иммунного анализа пока есть к чему стремиться, и возможны некоторые различия в результатах для разных лабораторий и для разных методов анализа. Если мы будем сильно погружаться в небольшие различия между результатами анализа, то можем разочароваться из-за изменчивости, которая типична для разных методов анализа и разных лабораторий. Я порекомендовал Джону взять результаты ТИА и РИД, вычислить среднее значение и считать его «настоящим». Так можно объединить результаты обоих методов анализа.
С точки зрения здоровья теленка в производственной обстановке различия между результатами анализа (при условии, что анализы проведены правильно), скорее всего, не критичны. Я рекомендую найти лабораторию с невысокими расценками, где люди хотят работать и идут на диалог, обеспечивают своевременную доставку результатов и последовательны в своих действиях. Обсудите ваши потребности и не давайте себе увязнуть в мелких различиях. Вам как животноводу действительно важно выявить тех телят, которые могут заболеть из-за кормления низкокачественным молозивом. Как правило, это те, у кого очень низкие концентрации IgG.
© FAO, 2022