
qнажмите здесь, чтобы открыть PDF-версию
Введение. Использование иммуноглобулинов (Ig) для снижения воздействия патогенных микроорганизмов является признанной практикой, применяемой на протяжении столетий. В данной ситуации мы говорим о получении телятами антител через питание не в течение первых 24 часов их жизни, а по истечении первых 24 часов. Хотя эти антитела не абсорбируются, они могут помочь иммунной системе теленка в поддержании здоровья желудочно-кишечного тракта. Всем нам знакома рекомендация скармливать телятам молозиво в течение первых 3 дней жизни. Скармливание молозива во 2-й и 3-й день жизни необходимо не из-за того, что антитела будут абсорбироваться в кровоток (они не будут), а потому, что оно создаст в кишечнике содержащую антитела «оболочку», помогающую поддерживать здоровье теленка. ПРИМЕЧАНИЕ. Дополнительную информацию см. в заметке о телятах №60.
Для понимания роли иммуноглобулинов в замещении антибиотиков важно помнить о том, что кишечник является самым большим органом иммунной системы в организме. Общая площадь поверхности слизистых оболочек, покрывающих эти трубкообразные ткани, как минимум в 200 раз больше, чем площадь поверхности кожи (Takahashi and Kiyono, 1999). Большой объем лимфоидной ткани (главным образом в виде пейеровых бляшек) в кишечнике также содействует выполнению им своей важной роли в поддержании иммунитета. Эти ткани имеют особую важность для противодействия кишечным заболеваниям, вызываемым вирусами и бактериями (Frost et al., 1997; Brodersen and Kelling, 1999). Таким образом, помимо выполнения важнейших пищеварительных функций, кишечник также предотвращает проникновение в организм возбудителей болезней.
Желудочно-кишечный тракт постоянно испытывает воздействие поражающих факторов, попадающих в организм животного вместе с питанием. В качестве таких факторов могут выступать патогенные организмы, токсины, вредные химические вещества, физические поражения (например, травматический гастрит) и многие другие. Органы желудочно-кишечного тракта обладают множеством способов противостояния таким факторам, включая секрецию пищеварительных ферментов и кислоты, предоставление «укрытия» организмам-симбионтам, и др. (Kruzel et al., 1998). Однако особый интерес представляет присутствие в кишечнике иммуноглобулина. Во втором случае задействуются функциональные элементы иммунной системы, находящиеся в слизистом и подслизистом слое, например, кишечно-ассоциированная лимфоидная ткань. Когда целостность кишечника нарушается инвазивными патогенами или полученной травмой, из клеток стенки кишечника выделяются мириады провоспалительных медиаторов, оказывающих действие на ткань или просвет кишечника. Иммуноглобулин представляет собой важный механизм защиты в составе общей иммунной реакции кишечного тракта. Выработка Ig кишечно-ассоциированной лимфоидной тканью является одной из ключевых функций данной ткани.
IgA, вырабатываемый клетками эпителия, традиционно считался единственным важным иммуноглобулином в кишечнике. И в самом деле, исследователи продолжают уделять основное внимание выработке кишечного IgA как средства контроля над заболеваниями (Sagodira et al., 1999; Coffin et al., 1999). Вместе с тем, новейшие данные указывают на то, что IgG также может играть важную роль в снижении риска заболеваемости у животных. Двумя основными источниками кишечного IgG являются выделение IgG из крови в кишечник и пероральное потребление IgG в составе молока или молозива (молочных выделений), крови или яиц.
Перемещение IgG из системы кровообращения в кишечник. В Университете штата Вашингтон д‑р Tom Besser и его сотрудники провели исследование, посвященное изучению перемещения IgG из системы кровообращения в кишечный тракт и роли IgG в снижении воздействий микробной нагрузки (1988a, b). Учеными было проведено два исследования с целью определения метаболического пути IgG, поступающего в кровоток. В рамках первого исследования телятам напрямую в кровь посредством инъекции был введен радиоактивно меченый (125I) IgG. Телята (в количестве 24 голов) были получены из товарного молочного хозяйства в США и были лишены молозива. Затем в течение определенного времени проводился мониторинг выведения радиоактивной метки путем сбора образцов мочи и кала с определением содержащегося в них уровня радиации. Измерялся общий уровень радиации, выведенной из организма, а также общий уровень радиации, остающейся связанной с белком (оценка «нетронутого» IgG).
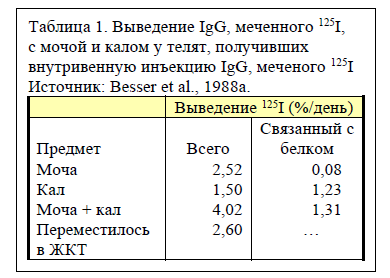
В среднем 2,52% изотопа 125I ежедневно выделялось с мочой (таблица 1). По большей части он не был связан с белком (всего лишь около 3% выведенного с мочой), и это показывает, что IgG, выведенный с мочой, до этого был катаболизирован. Также 1,5% от введенного изотопа 125I было выведено с калом. Его большая часть (82%) оставалась связанной с белком, демонстрируя, что IgG не подвергся разложению до его выведения с калом. Общий уровень выведения 125I составлял 4,02% от введенного объема в день. Согласно результатам регрессионного анализа, для введенного IgG, содержащего 125I, период полувыведения составил 17,9 дня.
Телята были подвергнуты эвтаназии, после чего было определено содержание 125I в различных отделах кишечника для непосредственной оценки количества IgG, переместившегося из системы кровообращения в кишечник. Общие значения соответствовали ежедневному уровню переноса в желудочно-кишечный тракт, равному 2,60% от общего введенного количества изотопа 125I. По всей видимости, этот IgG в основном секретируется в кишечник как «нетронутый» IgG, но некоторая его часть очевидно претерпевает распад под воздействием кишечных ферментов. Согласно оценке авторов случае, если теленок должен получить и абсорбировать 100 грамм IgG из материнского молозива в течение первых 24 часов, впоследствии он будет ежедневно выделять от 1 до 4 грамм IgG обратно в кишечник в первые 2 недели жизни.
В ходе второго эксперимента Besser с сотрудниками (Besser et al., 1988b) скармливали новорожденным телятам молозиво, содержащее антитела к определенному штамму ротавируса. Сухостойные коровы получили вакцину от ротавируса за 6 и 3 недели до ожидаемого времени отела для того, чтобы вырабатываемое ими молозиво могло содержать специфические антитела. Затем было измерено содержание специфических антител в крови и содержимом желудочно-кишечного тракта после умерщвления телят в 5- или 10-дневном возрасте.
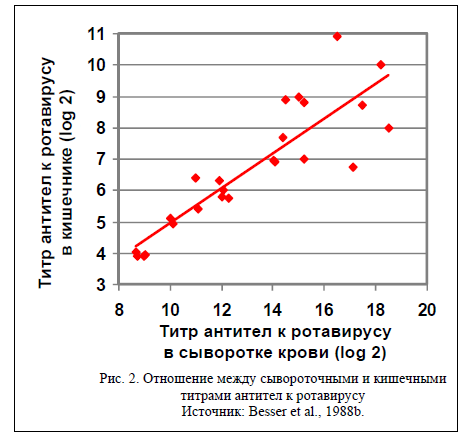
Установленное соотношение между количеством антител к ротавирусу в сыворотке и кишечнике (рис. 1) было близким. Это означает, что 1) телята абсорбировали специфические антитела из молозива, потребленного ими в течение первых 24 часов; 2) затем специфические антитела перешли из системы кровообращения в просвет кишечника, и 3) перемещение специфических антител в кишечник происходило пропорционально концентрации в крови.
Ценность кишечного IgG. Многие из бактерий и вирусов, приводящих к появлению инфекций у телят, являются кишечными организмами, обычно вызывающими повреждения кишечника и симптомы заболевания (такие как диарея и обезвоживание). Иммуноглобулины в кишечнике могут помогать животным в обеспечении эффективной иммунной реакции, прикрепляясь к центрам связывания специфического патогена. Таким образом, перемещение IgG из системы кровообращения в просвет кишечника может являться одним из способов обеспечения иммунной реакции на патогены, которыми животное заражается фекально-оральным путем.
Чтобы установить, имеет ли IgG из системы кровообращения какую-либо ценность для борьбы с кишечными патогенами, Besser с сотрудниками вводили телятам подкожно 1,25 литра сыворотки, полученной из молозива коров, вакцинированных от ротавируса, либо из молозива невакцинированных коров. Телятам в составе контрольной группы скармливали молозиво от невакцинированных коров. Затем эти телята были подвергнуты воздействию энтеропатогенного штамма ротавируса через 72 и 96 часов после рождения.
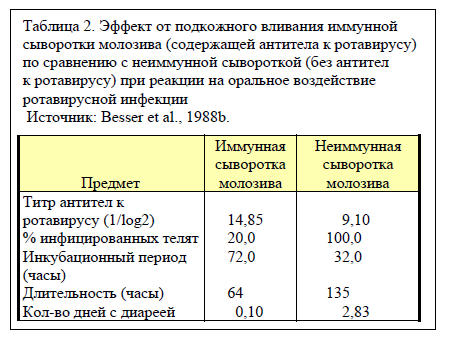
Введение IgG посредством подкожного вливания защитило телят от ротавирусной инфекции (таблица 2). Телята, получившие подкожное вливание «иммунной» сыворотки молозива (сыворотки, содержащей антитела к ротавирусу), имели более высокий титр сывороточных антител к ротавирусу и были лучше защищены от орального воздействия ротавирусной инфекции по сравнению с телятами, получившими вливание «неиммунной» сыворотки. Предположительно, способ действия «иммунной» сыворотки молозива был связан с перемещением IgG из системы кровообращения в просвет кишечника, где присутствовал ротавирус. Следует отметить, что эти телята не получали молозиво, поэтому единственным источником антител для них было подкожное вливание.
Эти исследования показывают, что:
- иммуноглобулины в кишечнике играют активную роль в сопротивляемости патогенным организмам, инфицирующим телят оральным путем, таким как ротавирус;
- иммуноглобулины в кишечнике являются в достаточной мере устойчивыми к перевариванию для того, чтобы обеспечить иммунную реакцию. В ходе исследований была задокументирована относительная устойчивость IgG к протеолитическому расщеплению в кишечнике;
- основным источником возникновения IgG в кишечнике новорожденных телят является IgG системы кровообращения, абсорбируемый из молозива, потребленного в течение первых 24 часов жизни теленка;
- повышенные концентрации IgG в сыворотке, как правило, создают повышенные концентрации IgG в просвете кишечника.
Сниженная усвояемость иммуноглобулинов. Иммуноглобулины более устойчивы к протеолизу, чем многие другие белки. Это необходимо для того, чтобы IgG мог обеспечивать локальный иммунный ответ в кишечнике животного. Согласно данным Roos et al. (1995) у пациентов-людей, получавших препараты Ig, меченные нерадиоактивным изотопом азота 15N, выход потребленных IgG и IgM, остающихся иммунологически активными, составил соответственно (19 ± 3)% и (19 ± 4)%. Согласно данным Roos et al., кишечная усвояемость IgG здоровыми людьми составила 79%. Примечательно, что иммунологическая активность в значительной степени была связана с антигенсвязывающими фрагментами F(ab’)2, вырабатываемыми за счет действия пепсина и трипсина на IgG. Фрагменты F(ab’)2 имеют молекулярный вес ~100 кДа.
Исследователи измерили уровни специфических материнских антител к ротавирусу в сыворотке у новорожденных поросят. Поросята были разделены по группам в соответствии с титром (не определяемый, низкий или высокий сывороточный титр, соответственно). После этого в возрасте 3 дней поросята были подвергнуты воздействию вирулентного ротавируса с последующим мониторингом на предмет инфекции и заболевания. У всех инокулированных поросят выделялся ротавирус и наблюдалась диарея, при этом у поросят с наиболее высоким уровнем антител к ротавирусу в системе кровообращения наблюдалась менее тяжелая диарея, а ротавирус у них выделялся в течение меньшего количества дней по сравнению с поросятами, имевшими более низкие титры антител. Согласно заключению исследователей, материнские антитела в системе кровообращения играют значительную роль в смягчении клинической картины заболевания, а перемещение антител из системы кровообращения в просвет кишечника имеет высокую важность для данной реакции. Очевидно, что перемещение антител из системы кровообращения в кишечник имеет важность для здоровья животных.
В последующих заметках о телятах мы рассмотрим три основных источника антител — молоко и молозиво, кровь и яйца. Каждый источник антител имеет свои преимущества и недостатки, и изучение каждого из них позволило обрести более глубокое понимание значения антител для здоровья теленка.
© FAO, 2022