
qнажмите здесь, чтобы открыть PDF-версию
Введение
В течение нескольких лет консультанты по выращиванию телят рекомендовали стандартный протокол для выпойки молозива новорожденным телятам, в который входила дача молозива с помощью пищеводного зонда (прекрасный пример использования этого устройства от Университета штата Висконсин можно найти здесь). Пищеводные зонды позволяют давать животным известное количество молозива за короткий промежуток времени. Но некоторые фермеры, выращивающие телят, предпочитают кормить новорожденных молозивом из бутылки. Среди причин использования пищеводного зонда фермеры, как правило, называют следующие: правильное расположение трубки в пищеварительном тракте новорожденного теленка, забота о его здоровье и желание контролировать потребление молозива. Часто возникает и другой вопрос: зависит ли абсорбция IgG из молозива от метода кормления. Обычно считается, что при кормлении через зонд молозиво сначала попадает в рубец, потому что пищеводный желоб не смыкается, когда телятам вводят зонд. Если молозиво остается в рубце в течение длительного периода времени, эффективность абсорбции IgG может снизиться. Однако некоторые исследования (Chigerwe et al., 2012; Godden et al., 2009) позволяют предположить, что метод кормления (через зонд или из бутылки) не оказывает значительного влияния на конечное значение IgG в сыворотке.
В большинстве предыдущих исследований при сравнении кормления из бутылки или через зонд оценивали цельное, жидкое молозиво. Меньшее число исследований посвящено оценке порошковых заменителей молозива и тому, влияет ли метод кормления на эффективность абсорбции IgG.
Исследование
В одной статье в журнале Journal of Dairy Science за 2018 год сообщается о значениях IgG в сыворотке телят, которых кормили заменителем молозива, полученного методом распылительной сушки, с помощью бутылки или пищеводного зонда. Исследование проводили на новорожденных телятах голштинской породы (n = 20, МТ при рождении = 44,8 килограмма) с коммерческой молочной фермы (г. Миллет, провинция Альберта, Канада). В течение 10 минут после рождения телят отделяли от матери, взвешивали и переводили в индивидуальные загоны с соломенной подстилкой. В опыте использовали заменитель молозива распылительной сушки на основе молозива КРС. Продукт (750 грамм) смешивали с водой до конечного объема 3 литра. В первое кормление телята получали с продуктом 200 грамм IgG. В возрасте 12 часов и через каждые 12 часов до возраста 48 часов телятам давали по 3 литра пастеризованного цельного молока. Поэтому единственным источником IgG было питание в первое кормление. Исследователи следили за концентрациями IgG в сыворотке и некоторыми другими компонентами крови. Для ясности в этой заметке о телятах мы сосредоточимся только на концентрации IgG в сыворотке крови. Исследователи также использовали маркер опорожнения сычуга, поэтому могли определять, можно ли отнести различия (если они были) в концентрациях IgG в сыворотке крови на счет различий в том, как молозиво выходит из сычуга и поступает в кишечник, где возникает абсорбция.
Результаты
Краткий обзор абсорбции молозивных IgG представлен в таблице 1. Потребление молозива происходило быстрее, если телят кормили через пищеводный зонд (это логично, поскольку питание через трубку занимает меньше времени, чем кормление из бутылки). Кроме того, поскольку не все телята, которых кормили из бутылки, потребляли молозиво полностью, потребление молозива было выше, если телят кормили через зонд. Это все доводы в пользу использования зонда для более быстрой и полной дачи молозива.
Максимальные концентрации IgG в сыворотке не различались и были > 24 г/л в обоих вариантах кормления. В целом, мы считаем, что концентрации IgG в сыворотке крови > 10 г/л указывают на «достаточную передачу пассивного иммунитета», поэтому эти значения служат признаком того, что IgG были успешно абсорбированы из молозивного продукта.
Было сделано интересное наблюдение: пиковые концентрации IgG были достигнуты в период с 13 до 16 часов. Всех телят кормили приблизительно через 2 часа после рождения. Поэтому эти данные позволяют предположить, что для возникновения пиковой концентрации IgG в сыворотке крови требуется 11–14 часов. Необходимо отметить, что в опыте было всего одно кормление заменителем молозива. Если бы исследователи провели второе кормление молозивным продуктом, скорее всего, пиковые концентрации возникли бы позже.
Таблица 1. Масса тела телят и потребление.
Концентрации IgG в сыворотке представлены на рис. 1. Очевидно, нет различий между кормлением через зонд или с помощью бутылки. Кроме того, скорость опорожнения сычуга (52–53% в час) была одинакова в разных вариантах питания. Из этого наблюдения мы можем сделать некоторые важные выводы.
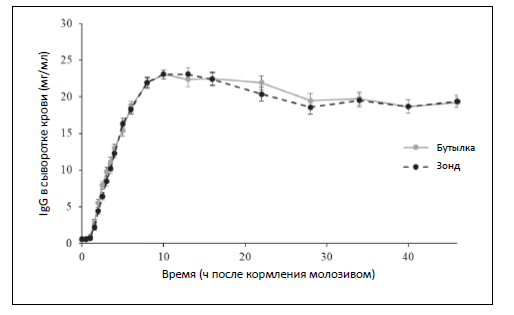
Если предположить, что молозиво, которое дают через зонд, входит в рубец, тогда как молозиво, потребляемое из бутылки, проходит мимо рубца и поступает прямо в сычуг, то можно ожидать, что сычуг будет опорожняться по‑разному, поскольку при кормлении через зонд в сычуге телят будет мало молозива. Однако в исследовании не отмечено различий в опорожнении сычуга. Возможно, причина кроется в размерах рубца новорожденного теленка. По данным исследования Chapman et al. (1986), объем рубца очень маленьких телят составляет всего 400 мл. Поэтому, если мы даем большое количество молозива (более 400 миллилитров) с помощью пищеводного зонда, объем рубца окажется недостаточным. Избыток молозива выйдет из рубца в книжку и сычуг. В данном случае телятам давали 3 литра молозива через зонд, поэтому, скорее всего, по крайней мере 2,5 литра молозива вытекло в сычуг, несмотря на то что телят кормили через зонд. Возможно также, что по мере опорожнения сычуга, все оставшееся в рубце молозиво перейдет в сычуг. Поэтому не отмечено влияния на опорожнение сычуга и на абсорбцию IgG.
Резюме
Телята, которых кормят через пищеводный зонд, абсорбируют столько же IgG, сколько и телята, питающиеся из бутылки с соской. Это справедливо как для материнского молозива, так и для заменителей молозива. Кроме того, по-видимому, кормление молозивом объемом более 400 миллилитров с помощью зонда приводит к «переливу» из рубца в друге части желудка теленка. Следовательно, метод кормления не оказывает существенного влияния на опорожнение сычуга или абсорбцию IgG.
© FAO, 2022