Clique aqui para uma versão em PDF desta Calf Note
Autor: Jim Quigley
Traduzido por: Rafael Alves de Azevedo, Paula Tiveron e Carla Maris Bittar
Introdução
Vários Calf Notes recentes examinaram as causas de acidose ruminal subaguda (ARS) em vacas e bezerros (#170, #172, #173). Este destina-se a avaliar os efeitos da ARS sobre a saúde das vacas e bezerros.
Como a acidose ruminal subaguda afeta a saúde?
Numa excelente revisão recente dos efeitos da ARS sobre a saúde das vacas, Plaizier et al. (2012) documentaram em grande detalhe os efeitos dos desafios à base de grãos na saúde das vacas. Quando as vacas (e, por extensão, os bezerros) comem muitos grãos em um curto período (ou quando são desafiadas com grandes quantidades de grãos), normalmente há uma redução do pH do rúmen, o que pode resultar em sub acidose ruminal aguda, ou ARS. Pesquisas sugerem que muitos dos bezerros, se não a maioria, experimentam a ARS em algum momento durante o período de desenvolvimento do rúmen. Na maioria das pesquisas, a ARS é definida como pH ruminal <5,8. Quando o pH cai para este nível, a digestão de fibras é reduzida e a vaca (bezerro) pode sofrer vários distúrbios metabólicos, como um ciclo on-off-on de ingestão de alimento, diarreia e desempenho inferior, entre outros problemas.
Um componente chave da ARS em saúde animal é a produção de lipopolissacarídeos (LPS) que resulta da morte de bactérias gram-negativas. Também chamado de endotoxina, o LPS é um sinal para o organismo que ocorreu uma invasão bacteriana, e o corpo responde mobilizando a resposta imune para combater essa nova infecção. Como resultado, há vários sinais claros causados por LPS – febre, produção de citocinas pró inflamatórias tais como TNF-α, anorexia, e, em casos graves, choque tóxico e morte.
Normalmente, o LPS é produzido no rúmen como resultado do crescimento e morte normal das células bacterianas ruminais. No entanto, as concentrações são geralmente baixas e os sistemas intestinais desintoxicam o LPS que deixa o rúmen. Por exemplo, as proteases do abomaso, a lisozima e o ácido clorídrico contribuem matando ou inibindo as bactérias. O baixo pH do abomaso também pode desativar o LPS (Ribeiro et al., 2010). Bertok (1998) também relatou que os ácidos biliares causam degradação de LPS no intestino delgado.
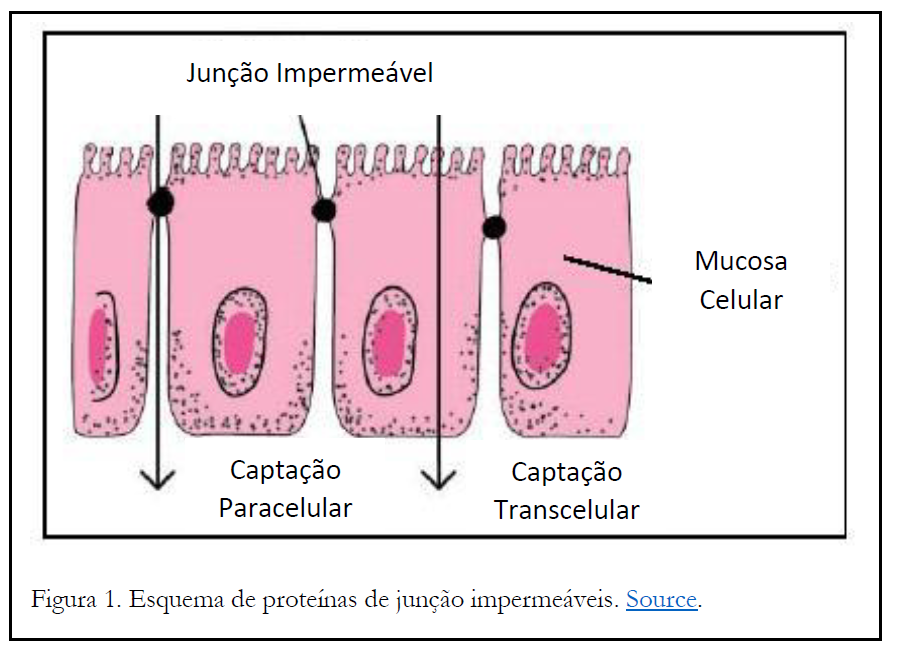
No caso de um desafio de grãos (ingestão de grande quantidade de grãos contendo grandes quantidades de amido), o aumento na quantidade de LPS no fluído ruminal tem sido demonstrado por vários autores. Sob certas condições, a quantidade de LPS absorvida no sangue pode aumentar. Uma possível razão para este aumento são os efeitos do estresse nas proteínas de junção impermeável. Junções impermeáveis são proteínas entre as células epiteliais do intestino (ver Figura 1) e geralmente limitam o movimento de moléculas entre as células (ou seja, a captação paracelular). Assim, a maioria dos nutrientes e outras moléculas devem ser absorvidas pelas células (captação transcelular). No entanto, sob certas condições, as proteínas da junção perdem sua capacidade de controlar o movimento de substratos do lúmen do intestino, e a quantidade de captação paracelular aumenta dramaticamente. Isto é muitas vezes referido como “gotejamento intestinal” e é causado por vários fatores, incluindo antígenos, microrganismos, citocinas, frio/calor, alterações na dieta (por exemplo, desmama) e outros fatores. O aumento da permeabilidade permite o aumento da captação de LPS e provoca uma resposta imune correspondente.
Efeitos da resposta imune induzida por ARS
Os dados sugerem que a ARS pode fazer com que o LPS se mova do intestino para a circulação periférica. Quando o LPS atinge o sangue, há uma resposta sistêmica, que causa a produção de proteínas de fase aguda, mudanças na utilização de nutrientes e redução da eficiência de produção. Em vacas em lactação, o aumento das proteínas da fase aguda do plasma está associado à redução da gordura do leite, leite corrigido para 3,5% de gordura e à eficiência da produção (Dong et al., 2011).
De onde vem o LPS?
A sabedoria popular sugeriu que o LPS produzido pela morte das bactérias do rúmen foi a principal fonte de LPS que eventualmente atingiu a corrente sanguínea e causou um desempenho reduzido. No entanto, Plaizier et al. (2012) argumentaram que outra fonte de LPS no sangue vem da alta acidez da digesta do intestino grosso. Eles argumentam que o nível de amido que atinge o intestino delgado e grosso é uma consideração importante. Ou seja, o amido que não é fermentado no rúmen (devido à grande ingestão de amido juntamente com alta taxa de passagem) e não digerido pelo intestino delgado pode atingir o intestino grosso, onde pode ser fermentado por bactérias do intestino grosso, produzindo grandes quantidades de ácidos de fermentação. Estes ácidos e morte bacteriana que ocorrem no intestino grosso também podem prejudicar as junções e resultar na passagem do LPS para circulação.
Quais efeitos em bezerros?
Embora pareça haver evidências claras de que a ARS exista em vacas e possa ter efeitos significativos na saúde, há poucos dados para sugerir efeitos semelhantes em bezerros. Claramente, no entanto, há sugestões de que mecanismos fisiológicos semelhantes podem desempenhar um papel nos bezerros.
Imediatamente após a desmama, é comum que a ingestão inicial aumente várias vezes em questão de dias, já que os bezerros tentam substituir a energia fornecida anteriormente pelo leite. Isso tem o efeito de duplicar ou triplicar a carga de carboidratos apresentados às bactérias do rúmen e no rúmen a serem processadas. Como as bactérias no rúmen são adeptas mesmo no início da vida para fermentar carboidratos, como amido e celulose, isso resultaria em um rápido aumento na produção de AGV, crescimento microbiano e, potencialmente, na produção de LPS no rúmen. O efeito combinado de baixo pH, alta acidez e produção de LPS pode resultar em translocação de bactérias através da parede do rúmen, desenvolvimento de paraqueratose ruminal e abscessos hepáticos. Nenhum desses efeitos é benéfico para o bezerro.
Quando as dietas de bezerros contêm muito amido, um cenário (como proposto por Plaizier et al.) pode proceder da seguinte maneira – aumento rápido na ingestão da ração com a desmama. Uma vez que a ração contém uma grande quantidade de amido, pode haver aumento de saída do amido do rúmen. A digestão do amido no rúmen, no intestino delgado e no intestino grosso varia muito entre os animais e as dietas (Huntington et al., 2006). Se mais amido atingir o intestino grosso, ele pode iniciar a produção de LPS e a resposta imune subsequente pela quebra da integridade intestinal e migração do LPS para a circulação.
No momento da redação deste texto, essa hipótese é uma conjectura. Não há dados que sugiram que o LPS ruminal ou intestinal aumente em bezerros recém-desmamados, nem que haja uma resposta imune a tal aumento.
No entanto, sabemos que o estresse do desmame pode resultar em imunossupressão (Hulbert et al., 2011; Kim et al., 2011). Curiosamente, Kim et al. (2011) relataram aumentos nas proteínas de fase aguda e concentrações de fator de necrose tumoral alfa em bezerros recém-desmamados, o que é consistente com as hipóteses aqui apresentadas. Mais pesquisas são necessárias para determinar se os nossos métodos de desmama e composição da ração em torno da desmama podem afetar a imunidade do bezerro e a predisposição à doença.
Referências
Bertok, L., 1998. Effect of bile acids on endotoxin in vitro and in vivo (physico-chemical defense): bile deficiency and endotoxin translocation. Ann. N.Y. Acad. Sci. 851:408–410.
Dong, G., S. Liu, Y. Wu, C. Lei, J. Zhou, and S. Zhang. 2011. Diet-induced bacterial immunogens in the gastrointestinal tract of dairy cows: impacts on immunity and metabolism. Acta Vet. Scand. 53:48-54.
Hulbert, L.E., C. L. Cobb, J. A. Carroll, and M. A. Ballou. 2011. The effects of early weaning on innate immune responses of Holstein calves. J. Dairy Sci. 94:2545-2556.
Huntington, G. B., D. L. Harmon, and C. J. Richards. 2006. Sites, rates, and limits of starch digestion and glucose metabolism in growing cattle. J. Anim. Sci. 84(E. Suppl.):E14-E24.
Kim, M.H., J. Y. Yang, S. D. Upadhaya, H. J. Lee, C. H. Yun, and J. K. Ha. 2011. The stress of weaning influences serum levels of acute-phase proteins, iron-binding proteins, inflammatory cytokines, cortisol, and leukocyte subsets in Holstein calves. J. Vet. Sci. 12:151-157.
Plaizier, J. C., E. Khafipour, S. Li, G.N. Gozho, D.O. Krause. 2012. Subacute ruminal acidosis (SARA), endotoxins and health consequences. Anim. Feed Sci. Technol. 172:9–21.
Ribeiro, M.M., Xu, X., Klein, D., Kenyon, N.S., Ricordi, C., Felipe, M.S., Pastori, R.L., 2010. Endotoxin deactivation by transient acidification. Cell Transplant. 19:1047–1054.