Clic aquí para una versión en PDF
Introducción. El uso de inmunoglobulinas (Ig) para reducir los efectos del desafío patógeno ha sido reconocido por cientos de años. En esta ocasión, no estamos hablando de proporcionarle anticuerpos a los terneros durante las primeras 24 horas de vida, sino después de las primeras 24 horas. Aunque estos anticuerpos no se absorben, pueden ayudar al sistema inmunitario de los terneros a mantener la salud gastrointestinal. Todos hemos escuchado sobre la recomendación de alimentar a los terneros con calostro durante los primeros tres días de vida. La razón para alimentarlos durante los días dos y tres no se debe a que los anticuerpos se absorberán en el torrente sanguíneo (no lo harán), sino a que «recubrirán el intestino» con anticuerpos que pueden ayudar a mantener al ternero sano. NOTA: para obtener información adicional, consulte la Nota Sobre Terneros # 60.
Para comprender el papel de las Ig en la sustitución de antibióticos, es importante comprender que el tracto intestinal es el órgano inmunológico más grande del cuerpo. El área total de estas superficies mucosas, que cubren estos tejidos en forma de tubo, es al menos doscientas veces más grande que la de la piel (Takahashi y Kiyono, 1999). La gran cantidad de tejido linfático (principalmente las Placas de Peyer) en el intestino, también contribuye a la capacidad inmunológica de este. Estos tejidos parecen ser particularmente importantes para las enfermedades entéricas causadas por virus y bacterias (Frost et al., 1997; Brodersen y Kelling, 1999). Por lo tanto, además de proporcionar funciones digestivas fundamentales, el intestino también debe evitar que las enfermedades ingresen al cuerpo.
El tracto gastrointestinal está constantemente expuesto a los objetos extraños o sustancias nocivas que consume el animal. Estos pueden incluir organismos patógenos, toxinas, productos químicos nocivos, agravios físicos (por ejemplo, la enfermedad del hardware) y muchos otros más. Los órganos en el tracto gastrointestinal tienen muchos métodos para lidiar con estos objetos y sustancias, incluida la secreción de enzimas digestivas y ácido, el alojamiento de organismos comensales y otros métodos (Kruzel et al., 1998). Sin embargo, es de particular interés la presencia de Ig en los intestinos. El segundo componente involucra elementos inmunológicos funcionales que se encuentran en los compartimientos mucoso y submucoso, por ejemplo, el tejido linfoide asociado al intestino. Cuando la integridad intestinal se ve afectada por patógenos invasivos o por traumatismos, las células en la pared intestinal liberan una gran cantidad de mediadores proinflamatorios que ejercen acciones en el tejido o lumen intestinal. La inmunoglobulina es un mecanismo de defensa importante en la respuesta inmune en general, en la intestinal y en la producción de Ig del tejido linfoide intestinal asociado, función fundamental de estos tejidos.
Tradicionalmente, la única Ig considerada importante en el intestino era la IgA, que es producida por las células epiteliales. De hecho, los investigadores continúan enfocándose en la producción de IgA intestinal como un medio para controlar las enfermedades (Sagodira et al., 1999; Coffin et al., 1999). Sin embargo, otra evidencia reciente sugiere que la IgG también puede jugar un papel importante en la reducción del riesgo de enfermedades en los animales. Las dos fuentes principales de IgG en el intestino son la secreción de IgG de la sangre al intestino y el consumo oral de IgG de la leche o el calostro (secreciones lácteas), sangre o huevos.
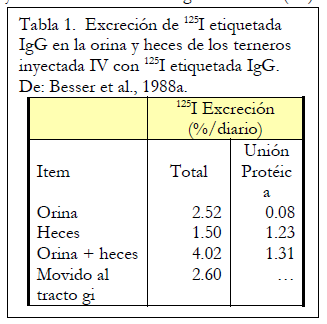
Un promedio de 2.52% del 125I se excretó en la orina todos los días (Tabla 1). La mayor parte de esto no se unió a las proteínas (solo alrededor del 3% de la excreción urinaria), lo que indica que la IgG excretada en la orina había sido catabolizada previamente. Además, el 1,5% del 125I inyectado se excretó en las heces. La mayor parte de esto (82%) todavía se unía a las proteínas, lo que indica que estas IgG no se degradaron antes de la excreción en las heces. La excreción total de 125I fue 4.02% por día de la cantidad inyectada. El análisis de regresión indicó que la vida media del 125I inyectado que contiene IgG fue de 17,9 días.
Las terneras se sacrificaron y se determinó la cantidad de 125I en varios compartimentos del intestino para estimar directamente la cantidad de IgG que se movía de la circulación hacia el intestino. Los valores totales correspondieron a una transferencia diaria del 2,60% del total de 125I infundido al tracto gastrointestinal. La mayor parte de esta IgG pareció ser secretada en el intestino como IgG intacta, pero una porción aparentemente fue degradada por las enzimas intestinales. Los autores estimaron que, si un ternero consumiera y absorbiera 100 g de IgG del calostro materno dentro de las primeras 24 horas de vida, posteriormente secretaría de 1 a 4 gramos de IgG nuevamente en el intestino diariamente durante las primeras dos semanas de vida.
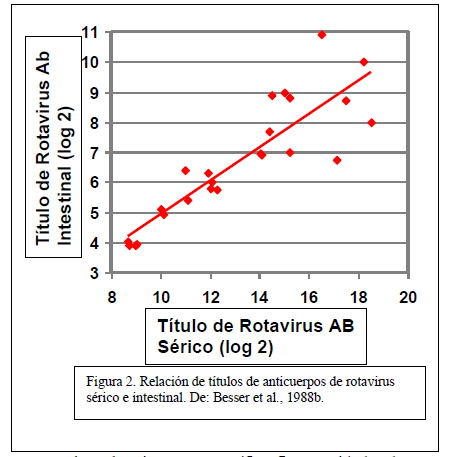
En un segundo experimento, Besser y sus colegas (Besser et al., 1988b) alimentaron a los recién nacidos con calostro que contenía anticuerpos contra una cepa específica de rotavirus. Las vacas secas se inmunizaron con una vacuna contra el rotavirus a las 6 y 3 semanas antes del parto esperado para producir calostro que contuviera el anticuerpo específico. Las cantidades de anticuerpo específico se midieron en la sangre y el contenido gastrointestinal después del sacrificio a los 5 o 10 días de edad.
La correlación entre el anticuerpo de rotavirus sérico y el anticuerpo de rotavirus intestinal (Figura 2) mostró una estrecha correlación. Esto significa que los terneros 1) absorbieron el anticuerpo específico del calostro consumido dentro de las primeras 24 horas, 2) los anticuerpos específicos luego se trasladaron desde la circulación hacia la luz del intestino, y 3) el movimiento de anticuerpos específicos hacia el intestino se produjo en proporción a las concentraciones en la sangre.
El valor de la IgG intestinal. Muchas bacterias y virus que infectan a los terneros son entéricos, por lo general causan daño intestinal y signos de enfermedad (diarrea, deshidratación). Las inmunoglobulinas en el intestino podrían ayudar al animal a elevar una respuesta inmune efectiva cuando se unen a los sitios de unión antigénica en el patógeno específico. Por lo tanto, el movimiento de IgG circulante hacia el lumen intestinal sería una forma de proporcionar inmunidad en respuesta a los patógenos que infectan al animal por la ruta fecal-oral.
Para determinar si la IgG circulante tiene algún valor al tratar con patógenos intestinales, Besser y sus colegas inyectaron a las terneras por vía subcutánea 1,25 litros de suero extraído del calostro de las vacas inmunizadas contra el rotavirus o el calostro de las vacas no inmunizadas. El grupo control fue alimentado con calostro de vacas no inmunizadas. Luego, estos terneros fueron desafiados con una cepa de rotavirus enteropatógena a las 72 y 96 horas después del nacimiento.
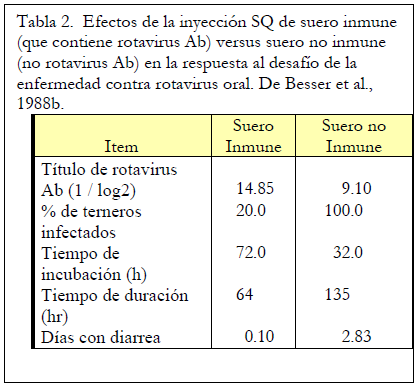
La administración de IgG por inyección subcutánea protegió a los terneros contra la infección por rotavirus (Tabla 2). Los terneros tratados con suero «inmune» subcutáneo (suero que contiene anticuerpos contra rotavirus) tenían títulos de anticuerpos séricos más altos contra el rotavirus y estaban más protegidos contra el desafío del rotavirus oral que los terneros que fueron inyectados con suero «no inmune». Presumiblemente, el modo de acción para el suero inmune fue a través del movimiento de la IgG circulante hacia el lumen intestinal, donde estaba presente el rotavirus. Es importante tener en cuenta que estos terneros no recibieron calostro, por lo que la única fuente de anticuerpos fue a través de inyección subcutánea.
Estos estudios indican que:
- La Ig en el intestino desempeña un papel activo en la resistencia a los organismos patógenos que infectan a los terneros por vía oral, tales como el rotavirus.
- Las Ig en el intestino son suficientemente resistentes a la digestión para proporcionar una respuesta inmune. Los estudios han documentado la resistencia relativa de IgG a la degradación proteolítica en el intestino.
- Una fuente importante de IgG en el intestino de los terneros recién nacidos es la IgG circulante que se absorbe por la ingestión de calostro en las primeras 24 horas.
- Concentraciones mayores de IgG en el suero generalmente producen concentraciones mayores de IgG en el lumen del intestino.
Digestibilidad reducida de Ig. Las inmunoglobulinas son más resistentes a la proteólisis que muchas otras proteínas. Esto es necesario para que la IgG proporcione una respuesta local en el intestino del animal. Roos et al. (1995) informaron que las recuperaciones de N de IgG e IgM ingeridas aun inmunológicamente activas fueron 19±3% y 19±4%, respectivamente, en pacientes humanos que consumieron preparaciones de Ig etiquetadas con 15N. Según los datos de Roos et al., La digestibilidad ileal de IgG en humanos sanos fue del 79%. Curiosamente, gran parte de la actividad inmunológica se asoció con los fragmentos F(ab’)2, que son producidos por la actividad de pepsina y tripsina en IgG. Los fragmentos F(ab’)2 contienen un peso molecular de ~ 100 kDa.
Los investigadores midieron en cerdos neonatales los niveles séricos de anticuerpos específicos contra rotavirus derivados de la madre. Los cerdos se agruparon en títulos bajos o altos de suero no detectables. Los cerdos fueron desafiados con rotavirus virulento a los 3 días de edad y monitoreados para detectar infecciones y enfermedades. Todos los cerdos inoculados arrojaron rotavirus y desarrollaron diarrea, y los cerdos con los niveles más altos de anticuerpos circulantes contra rotavirus desarrollaron diarrea y rotavirus menos graves durante menos días que los cerdos con títulos de anticuerpos más bajos. Los investigadores concluyeron que los anticuerpos maternos circulantes juegan un papel importante en la mitigación de la enfermedad clínica y el movimiento de anticuerpos desde la circulación hacia el lumen intestinal es importante en esta respuesta. Aparentemente, el movimiento de anticuerpos desde la circulación hacia el intestino es importante para la salud animal.
En Futuras Notas Sobre Terneros se analizarán las tres fuentes principales de anticuerpos, leche y calostro, sangre y huevos. Cada uno tiene ventajas y desventajas, y la investigación con cada fuente de anticuerpos ha proporcionado información sobre el valor de los anticuerpos en la salud de los terneros.
Referencias
- Besser, T. E., T. C. McGuire, C. C. Gay, and L. C. Pritchett. 1988a. Transfer of functional immunoglobulin G (IgG) antibody into the gastrointestinal tract accounts for IgG clearance in calves. J. Virology. 62:2234-2237.
- Besser, T. E., C. C. Gay, T. C. McGuire, and J. F. Evermann. 1988b. Passive immunity to rotavirus infection associated with transfer of serum antibody into the intestinal lumen. J. Virology. 62:2238-2242.
- Brodersen, B.W. and C. L. Kelling. 1999. Alteration of leukocyte populations in calves concurrently infected with bovine respiratory syncytial virus and bovine viral diarrhea virus. Viral Immunol. 12:323-334.
- Coffin S. E., S. L. Clark, N. A. Bos, J. O. Brubaker, and P. A. Offit. 1999. Migration of antigen-presenting B cells from peripheral to mucosal lymphoid tissues may induce intestinal antigen-specific IgA following parenteral immunization. J. Immunol. 163:3064-3070.
- Frost, A. J., A. P. Bland and T. S. Wallis. 1997. The early dynamic response of the calf ileal epithelium to Salmonella typhimurium. Vet. Pathol. 34:369-386.
- Kruzel M. L., Y. Harari, C. Y. Chen, and G. A. Castro. 1998. The gut. A key metabolic organ protected by lactoferrin during experimental systemic inflammation in mice. Adv. Exp. Med. Biol. 443:167-173.
- Roos, N., S. Mahe, R. Benamouzig, H. Sick, J. Rautureau, and D. Tome. 1995. 15N-labelled immunoglobulins from bovine colostrum are partially resistant to digestion in human intestine. J. Nutr. 125:1238-1244.
- Sagodira S., S. Iochmann, M. N. Mevelec, I. Dimier-Poisson, and D. Bout. 1999. Nasal immunization of mice with Cryptosporidium parvum DNA induces systemic and intestinal immune responses. Parasite Immunol.199921:507-516.
- Takahashi, I. And H. Kiyono. 1999. Gut as the largest immunologic tissue. J. Parenter. Enteral Nutr. 23(Suppl.):S7-12.