
qнажмите здесь, чтобы открыть PDF-версию
Введение
Кокцидиоз — заболевание, вызываемое одноклеточными рода Eimeria, которое негативно сказывается на здоровье и экономических показателях разных видов скота. Болезнь приводит к снижению массы тела, сокращению потребления и эффективности корма, а смертность в ряде случаев может достигать 24% (Fitzgerald, 1975). Согласно оценкам, 77 млн голов молодняка в Соединенных Штатах заражаются кокцидиями в первый год жизни. Из них 4 млн потребуется лечение от кокцидиоза, и возможен падеж 80 тыс. голов из-за болезни (Fitzgerald, 1975). Ежегодные экономические убытки от кокцидиоза оцениваются в 62 млн долларов США (Williams, 1984).
Как правило, кокцидиоз поражает молодых животных в возрасте до 2 лет. Чаще всего заражаются животные, содержащиеся вместе. Поэтому наиболее восприимчивы к заболеванию молочный скот и скот, содержащийся на кормовых площадках. Кокцидиоз скота на кормовых площадках связан со стрессом, вызванным перевозкой, изменением рациона и климатических условий, а также скученностью (Ernst and Benz, 1986). Молочный скот становится очень восприимчивым к кокцидиозу стресс при отъеме.
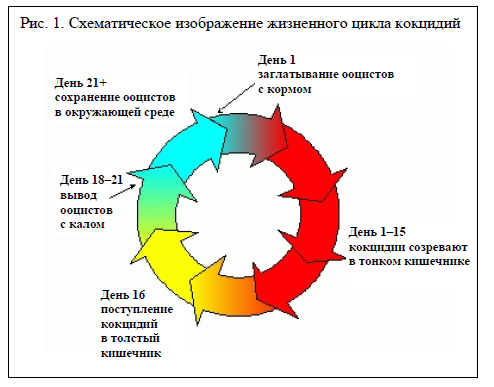
Этиология
Кокцидиальным инфекциям подвержены все виды домашних животных. Хотя кокцидии хозяин‑специфичны, каждый хозяин может быть инфицирован несколькими видами кокцидий одновременно. Известно как минимум 13 разных видов кокцидий, заражающих скот в Соединенных Штатах (Ernst and Benz, 1986), но не все они патогенные. Два наиболее патогенных вида — Eimeria bovis и Eimeria zuernii (Ernst и Benz, 1986). Период инкубации E. zuernii и E. bovis, как правило, составляет 15–20 дней (Georgi, 1985). Иммунитет к кокцидиозу сохраняется всего 3–4 месяца, и в отсутствие постоянного контакта возможна реинфекция (Fitzgerald, 1975).
Как правило, кокцидии на стадии развития инфицируют эпителиальные клетки слизистой оболочки кишечника (Ernst and Benz, 1986), но бывают и исключения. Например, крупные шизонты первого поколения E. bovis и E. zuernii можно обнаружить в клетках эндотелия центральных лимфатических капилляров тонкого кишечника (Hammond et al., 1946) и в клетках соединительной ткани собственной пластинки (Stockdale, 1976) соответственно.
Кокцидиоз передается путем заглатывания спорулированных ооцистов. Инфицирование происходит через зараженный корм, воду и пастбища или в результате лизания зараженного волосяного покрова (Georgi, 1985). К симптомам болезни относятся потеря аппетита, снижение веса, а также геморрагическая и мукоидная диарея (Georgi, 1985). В тяжелых случаях кал жидкий, с кровью и может содержать фрагменты отторгнутой слизистой оболочки кишечника (Ernst and Benz, 1986). Животные становятся истощенными, обезвоженными, слабыми и вялыми. Натуживание без дефекации может приводить к ректальному пролапсу (Ernst and Benz, 1986).
Клиническое течение кокцидиоза составляет 4–14 дней, уровень смертности при очень сильных вспышках может достигать 24% (Fitzgerald, 1975). Летальный исход обусловлен главным образом диареей, вызывающей потерю электролитов и обезвоживание, но также может быть связан с кровоизлиянием или вторичными осложнениями, например условно-патогенными инфекционными заболеваниями. Выздоровевшие после тяжелых инфекций животные могут отличаться стабильным снижением экономических показателей (Ernst and Benz, 1986).
Клинический и субклинический кокцидиоз создает экономические и ветеринарные проблемы для животноводов. Обе формы приводят к ухудшению состояния стада и в отсутствие лечения — к падежу скота. Клинический кокцидиоз связан с реакциями, возникшими в ходе болезни, т. е. симптомами. Согласно оценкам, клинические признаки кокцидиоза демонстрируют 5% зараженных животных (Muirhead, 1989). Напротив, субклинический кокцидиоз относится к периоду до появления типичных симптомов заболевания или к зараженным животным без признаков клинической инфекции. Субклинический кокцидиоз возникает у 95% животных и приводит к снижению экономических показателей (Muirhead, 1989). Поскольку субклинические кокцидиальные инфекции не имеют симптомов, производители могут не знать о заражении скота. Негативные последствия клинического и субклинического кокцидиоза обусловлены снижением поглощения питательных веществ из-за повреждения оболочки кишечника (Muirhead, 1989).
Смертность от кокцидиоза, как правило, связана с тяжелой диареей, вызывающей потерю электролитов и обезвоживание. По данным одного исследования, телята с диареей по сравнению со здоровыми теряли в 8 и 18 раз больше натрия и калия соответственно (Blaxter and Wood, 1958). Денатурация белков приводит к изменению осмотического давления и уровней внутриклеточных и внеклеточных ионов (Fitzgerald, 1967, Roy et al., 1959). Кокцидии разрушают клетки кишечника, в результате в тонкий кишечник попадают кровь и другие жидкости (Blaxter and Wood, 1958), которые затем выводятся с калом, имеющим, как правило, водянистую консистенцию. После созревания шизонтов клетки кишечника теряют мембраны, и либо собственная пластинка слизистой оболочки остается покрытой рассеянными эпителиальными клетками, либо происходит обнажение набухших капилляров пластинки (Blaxter and Wood, 1958). При серьезном повреждении этих капилляров может происходить потеря крови и плазмы.
Диагностика кокцидиоза вызывает у животноводов и ветеринаров трудности, так как клинические признаки связаны с завершением начальной стадии размножения (Muirhead, 1989). Симптомы кокцидиоза появляются после отхождения ооцистов, поэтому наличие в кале большого количества ооцистов свидетельствует о том, что кокцидии, вероятно, уже завершили свой жизненный цикл (Ernst and Benz, 1986). Если в это время начать лечение, контролируя вторичные бактериальные инфекции, то животные чаще всего выздоравливают (Georgi, 1985).
Лечение
Хотя кокцидиоз считается заболеванием молодняка, взрослые животные часто заражаются эймериями. Тяжесть клинического кокцидиоза зависит от количества проглоченных спорулированных ооцистов и общего состояния здоровья инфицированного хозяина (Ernst and Benz, 1986). В связи с этим контроль может быть направлен на сокращение числа доступных для проглатывания ооцистов. Вместе с тем минимальная инфицирующая доза кокцидий неизвестна (Muirhead, 1989). Важную роль в профилактике кокцидиоза играют надлежащая санитария и передовые методы зоотехники. Поилки и кормушки должны иметь такую конструкцию и располагаться таким образом, чтобы сокращать загрязнения фекалиями. Новорожденные молочные телята после отъема от матери должны находиться в чистом, сухом помещении (Ernst and Benz, 1986).
Главная трудность при лечении клинического кокцидиоза связана с тем, что симптомы заболевания проявляются почти в самом конце жизненного цикла. К этому времени кишечник животного может быть серьезно поврежден. Большинство противококцидных препаратов эффективны только на ранних стадиях жизненного цикла кокцидий. Таким образом, трудность при лечении кокцидиоза состоит в том, что к моменту появления симптомов паразиты уже прошли стадию, когда противококцидные препараты наиболее эффективны. Зараженные животные часто выздоравливают без всякого лечения благодаря приобретенной устойчивости к болезни (Blaxter and Wood, 1958). Вместе с тем лечение противококцидными препаратами необходимо начинать при появлении самых первых клинических признаков, поскольку это может снизить тяжесть болезни и сократить смертность. Для борьбы со вторичными инфекциями можно использовать антибиотики. Во избежание обезвоживания необходимо давать животным растворы электролитов и жидкости. На время лечения животные должны быть изолированы в чистое место, чтобы предотвратить дальнейшее заражение.
Лечение кокцидиоза включает прием сульфонамидов с питьевой водой и ампролиума с кормом. Полиэфирные антибиотики, такие как ласалоцид и монензин, первоначально разработанные как кокцидиостатики для домашней птицы, оказались эффективны и при профилактике кокцидиоза у скота.
Бороться с кокцидиозом у телят и взрослого скота, вызванным E. bovis и E. zuernii, помогает декоквинат. Декоквинат, применяемый в дозе 0,5 мг/кг массы тела в течение как минимум 28 дней в период воздействия спорулированных ооцистов, помогает контролировать заболевание (Miner and Jensen, 1976). Эффективность декоквината достигается при дозировке 22,7 мг/100 фунтов массы тела животного в сутки (Muirhead, 1989). Исследование, проведенное в Университете штата Северная Каролина (Ramsey et al., 1991), свидетельствует об эффективности декоквината в увеличении потребления корма и прироста при помещении животных в среду, где ранее были обнаружены кокцидии.
Монензин, применяемый в дозе 1 мг/кг массы тела в сутки в течение инкубационного периода экспериментального заражения E. bovis, предотвращал развитие клинических признаков кокцидиоза (Fitzgerald and Mansfield, 1973). Вместе с тем монензин не оказывал полного кокцидиостатического действия. Монензин в дозировке 16,5 или 33 грамма на метрическую тонну корма в течение 31 дня предотвращал развитие симптомов кокцидиоза (McDougald, 1978).
В исследованиях оценивалась эффективность ласалоцида как кокциодиостатика при использовании различных концентраций в корме (Conlogue et al., 1984). Вместе с тем рекомендуемый уровень ласалоцида для борьбы с кокцидиозом составляет 1 мг/кг массы тела (Muirhead, 1989), что позволяет снизить у телят выделение ооцистов с калом при естественной подверженности кокцидиозу (Hoblet et al., 1989). Ласалоцид в дозе 33–44 мг/кг корма показал высокую эффективность против кокцидиоза естественного происхождения у скота, содержащегося на кормовой площадке (Horton and Brandt, 1981).
Поскольку ионофоры обладают как противококцидными, так и усиливающими рост свойствами, важно установить, является ли увеличение массы тела и прироста реакцией на кокцидный контроль или на изменение ферментативных процессов в рубце. Мы проведи исследование (Sinks et al., 1992), чтобы выяснить, как реагируют на ласалоцид молодые телята. Шестнадцать телят голштинской породы после рождения случайным образом распределили по 4 схемам (конфигурация точек плана факторного эксперимента 2 × 2) со стартером для телят, содержащим 0 (L−) или 40 г/т ласалоцида (L+), и одиночной оральной инфекцией с 0 (C−) или 30 000 (C+) спорулированных ооцистов (E. bovis), применяемых в течение 28 дней после начала исследования. Спорулированные ооцисты вводились оральным способом в одной желатиновой капсуле.
Данные в таблице 1 показывают, что кокцидиальная инфекция и корм с ласалоцидом существенно влияли на массу тела и потребление. При кормлении телят L+ ежедневный прирост повышался, а при инфицировании C+ — снижался. Добавление L+ в корм повышало прирост на 8% у незараженных и на 50% у зараженных телят. Значимое взаимодействие между схемами лечения по неделям показало, что L+ увеличивал средний суточный прирост в период 5–8 недель, а эффект C+ был наиболее выражен на 7–8 неделе.
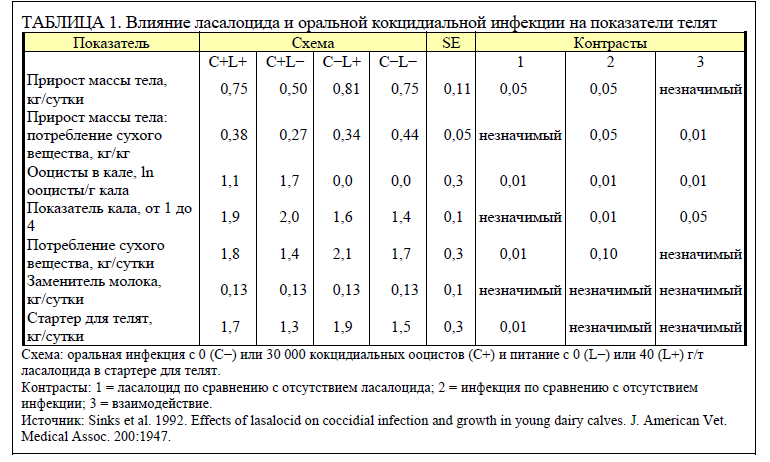
Коэффициент отношения между кормом и приростом при инфицировании телят C+ снижался, но высокозначимое взаимодействие (P < 0,01) показало существенное сокращение эффективности корма у телят на схеме C+L−. Наиболее заметное снижение коэффициента отношения между кормом и приростом наблюдалось в течение недель 7 и 8 у зараженных кокцидиями телят. Средние коэффициенты отношения между кормом и приростом для схем C+L+, C+L−, C−L+ и C−L− в течение 7-й и 8-й недель составили 0,29, −0,08, 0,41 и 0,41 соответственно.
Логарифмы количества кокцидий (таблица 1) показывают заметный рост у телят, инфицированных C+. Вместе с тем у телят, получавших L+, логарифм ооцистов в кале после заражения снизился (P < 0,01) с 1,71 до 1,14. Ооцисты (все E. bovis) начали появляться в кале телят C+L− и C+L+ приблизительно через 21 день после заражения. Телята, получавшие L+, выделяли меньше ооцистов по сравнению с телятами, не получавшими лечения (P < 0,01). Примерно через 4 недели после заражения количество ооцистов, выделяемых телятами, зараженными C+, начало снижаться вплоть до окончания исследования, что позволяет предположить формирование у телят устойчивости к кокцидиям или отсутствие повторного заражения кокцидиальными ооцистами. Ласалоцид эффективно снижал количество ооцистов, выделяемых телятами на схеме C+L+, хотя кокдициостатический эффект был неполным.
Спустя 3 недели после заражения кокцидиями у телят наблюдалась диарея. У телят на схеме C+L− в период выделения ооцистов развилась умеренная или тяжелая диарея (показатель кала > 2), в том числе в одном случае геморрагическая. У телят на схеме C+L+ в период выделения ооцистов развилась умеренная диарея (показатель кала > 2) (таблица 1). У одного теленка на схеме C−L+ наблюдалась диарея в ходе исследования. Кал этого теленка не содержал ооцистов или крови.
Результаты данного исследования четко свидетельствуют о влиянии умеренной дозы кокцидиальной инфекции E. bovis на рост, потребление и некоторые метаболические параметры телят после четырехнедельного возраста. Влияние инфекции на телят на схеме C+L− наблюдалось приблизительно через 3 недели после заражения. Масса тела снижалась в течение недель 6–8; в дальнейшем у телят могла сформироваться естественная устойчивость к кокцидиям. Прирост массы тела снижался только тогда, когда количество ооцистов в кале превышало приблизительно 1000 на грамм кала в течение 7-й и 8-й недель. У телят на схеме C+L+ количество ооцистов в кале никогда не достигало этого уровня, поэтому прирост не пострадал. Телята, не зараженные кокцидиями, не выделяли ооцистов, что говорит об отсутствии перекрестного заражения между группами. Следует отметить, что телята размещались в телятнике, в котором ранее другой скот не содержался, поэтому отсутствие ооцистов в кале незараженных телят было ожидаемым. Кокцидиальная инфекция также сказывалась на эффективности корма. Сокращение эффективности корма примерно на 30%, вероятно, было обусловлено снижением усвоения питательных веществ в тонком кишечнике. Кокцидии разрушают оболочку тонкого кишечника, что приводит к неполному всасыванию питательных веществ (Ernst and Benz, 1986). Анорексический эффект кокцидиоза (Williams, 1984) наряду с угнетением кишечной абсорбции заметно снижает эффективность корма у телят на схеме C+L−.
Хотя потребление ласалоцида не превышало 200 мг/голова/сутки, по-видимому, ласалоцид оказывал реальное влияние на среду формирующегося рубца и последующий рост. Благодаря влиянию ласалоцида показатели прироста были выше, чем другие результаты в нашей лаборатории (Quigley et al., 1991). Кроме того, телята, получавшие ласалоцид в течение 6 последних недель исследования, потребляли больше корма, это позволяет предположить, что после формирования функции рубца ласалоцид менял рубцовую среду. Anderson et al. (1988) также сообщали об увеличении потребления корма телятами, получавшими 44 грамма ласалоцида на тонну стартера после шестинедельного возраста, а также о росте показателей рубцовой ферментации и микробных чисел. Очевидно, ласалоцид влиял на потребление и рост, активизируя рубцовую ферментацию, а также подавляя кокцидии.
© FAO, 2022